Ioni metalici în soluție apoasă
Un ion metalic în soluție apoasă sau mai simplu , o soluție apoasă este un cation dizolvat în apă, cu generală formula [M (H 2 O) n] z +. Numărul de solvabilitate n poate fi determinat experimental și poate varia de la 4 la 9 (și mai mult). De exemplu, n este 4 pentru Li + și Be 2+, 6 pentru elementele perioadelor 3 și 4 din tabelul periodic , și 8 sau 9 pentru lanthanoids și actinoids . Puterea legăturii dintre cationul metalic și moleculele de apă din prima sferă de solvatare crește odată cu creșterea densității de sarcină pozitivă a cationului și, prin urmare, crește pe măsură ce sarcina electrică z pe metal crește și scade pe măsură ce raza sa r crește . Aquoions pot da naștere la reacții de hidroliză . Pentru majoritatea aposului, logaritmul primei constante de hidroliză este proporțional cu z 2 / r . Apa interacționează prin legătura de hidrogen cu celelalte molecule de apă prezente în a doua sferă de solvatare. Moleculele de apă din prima sferă de solvatare se schimbă cu cele prezente în a doua sferă de solvatare și restul soluției. Timpul de ședere al unei molecule de apă în prima sferă de solvatare este foarte variabil în funcție de ionul metalic și poate varia de la aproximativ 100 picosecunde la mai mult de 200 de ani.
Introducere
Elemente metalice sau semi-metalice Acolo Bine N / A Mg Pentru K. Aproximativ Sc Tu V. Cr Mn Fe Co Ni Cu Zn Ga GE Rb Sr. Da Zr Nb Mo Tc Ru Rh Pd Ag CD În Sn Sb Cs Ba Acolo Există Relatii cu publicul Nd P.m Sm Eu Doamne Tb Dy eu am Er Tm Yb lu Hf Ta W rege Os Ir Pt Au Hg Tl Pb Bi Pic Pr Ra B.C Th Pa U Np Pu A.m Cm Bk Cf Ex Fm Md Nu Lr Rf Db Sg Bh Hs Mt. Ds Rg Cn Nh Fl Mc Lv Ts Og
Majoritatea elementelor chimice sunt metalice , iar în stare de oxidare +1, +2 sau +3 în apă formează acvaiuri simple cu formula [M (H 2 O) n ] z + . (Tabelul include, de asemenea, semimetalele germaniu și antimoniu , deoarece acestea formează acquoioni într-un mod similar cu metalele. În ceea ce privește elementele transuranice de la bohrio la tennesso , chimia lor în soluție apoasă nu este cunoscută, dar se așteaptă ca comportamentul lor să fie În ceea ce privește oganesson , opiniile asupra comportamentului său metalic posibil sunt împărțite.) Când starea de oxidare devine mai mare de +3 acvaiile simple reacționează prin disocierea protonilor pentru a reduce sarcina pozitivă excesivă și astfel formează complexe care conțin ambele molecule de apă. decât ionii de hidroxid sau oxid ; un exemplu este specia de vanadiu (IV), [VO (H 2 O) 5 ] 2+ . În cele mai ridicate stări de oxidare, toți protonii sunt disociați și se cunosc doar oxoanioni, cum ar fi speciile de mangan (VII), MnO 4 - . [1]

În soluție apoasă, moleculele de apă legate direct de ionul metalic fac parte din prima sferă de coordonare, cunoscută și sub numele de prima sferă de solvație sau prima sferă de hidratare. Legătura dintre aceste molecule de apă și ionul metalic se numește legătură de coordonare : oxigenul furnizează o pereche de electroni pentru a forma legătura. Fiecare moleculă de apă coordonată poate fi conectată prin legătură de hidrogen la alte molecule de apă externe, care formează a doua sferă de coordonare, numită și a doua sferă de solvatare. Pentru 1+ sau 2+ cationi de sarcină, a doua sferă de solvabilitate nu este o entitate atât de bine definită. În soluție diluată, a doua sferă de solvatare se estompează spre corpul soluției, unde dispunerea moleculelor de apă este dată de o rețea neregulată de legături de hidrogen între diferitele molecule. [2] Ionii de încărcare 3+ au o sarcină suficient de mare pentru a polariza moleculele de apă din prima sferă de solvatare, astfel încât legăturile de hidrogen cu moleculele din a doua sferă de solvatare sunt suficient de puternice pentru a forma o entitate mai mare. Stabilă. [3]
Puterea legăturii metal-oxigen (M - O) poate fi estimată în diferite moduri. Cea mai fiabilă măsurare se obține din entalpia de hidratare, chiar dacă determinarea sa se bazează indirect pe măsurători experimentale. Scara valorilor se bazează pe un zero ales în mod arbitrar, dar acest lucru nu afectează diferențele dintre valorile a două metale. Alte măsurători se bazează pe frecvența vibrațiilor M-O și pe lungimea legăturii M-O. Puterea legăturii M - O tinde să crească odată cu încărcarea și să scadă odată cu creșterea dimensiunii ionului metalic. Într-adevăr, există o corelație liniară foarte bună între entalpia de hidratare și raportul dintre sarcina pătrată și raza ionului, z 2 / r . [4] Pentru ioni în soluție, „raza ionică efectivă” a Shannon este cea mai utilizată măsură. [5]
Moleculele de apă se pot schimba între prima și a doua sferă de solvatare (și restul soluției). În funcție de metal și de starea sa de oxidare, cursul de schimb variază foarte mult. Soluțiile apoase în soluție sunt întotdeauna însoțite de anioni solvatați, dar se știe mult mai puțin despre solvarea anionilor decât despre solvarea cationilor. [6]
Înțelegerea naturii apoase este ajutată de informații cu privire la comportamentul cationilor solvatați în solvenți amestecați [7] și neapoși, cum ar fi amoniac lichid, metanol , dimetilformamidă și dimetil sulfoxid . [8] [9]
Prezență în natură
Majoritatea apelor de origine naturală conțin aquoions. În apa de mare , principalele ape prezente sunt cele ale Na + , K + , Mg 2+ și Ca 2+ .
Aquoions în apa de mare (Salinitate = 3,5%) Ion Concentraţie
(mol kg −1 )Na + 0,469 K + 0,0102 Mg 2+ 0,0528 Ca 2+ 0,0103
Apa de mare conține multe alte elemente apoase în concentrații cuprinse între 1 × 10 −3 și 1 × 10 −9 g / L. [10] Apa potabilă și apa minerală conțin în mod normal ioni de magneziu și calciu, care sunt responsabili de duritatea permanentă și, respectiv, temporară. Sângele conține concentrații de sodiu, potasiu, magneziu și calciu similare cu cele ale apei de mare și conține, de asemenea, concentrații mai mici de elemente esențiale precum fierul și zincul. Băuturile sportive sunt formulate pentru a fi izotonice și conțin, de asemenea, minerale care se pierd prin transpirație .
Metode experimentale
În funcție de tehnica experimentală utilizată, este posibil să se obțină informații diferite despre natura aposului în soluție. Unele metode oferă informații numai despre cation, alte metode oferă informații care depind atât de cation, cât și de anion. Unele metode oferă informații de tip static, înregistrând media proprietăților într-un anumit moment, în timp ce alte metode oferă și informații despre dinamica proceselor în soluție.
Rezonanță magnetică nucleară (RMN)
Când rata de schimb a moleculelor de apă în jurul unui ion [M (H 2 O) n ] z + este lentă în scara de timp a măsurătorilor rezonanței magnetice nucleare , se obțin vârfuri distincte pentru moleculele de apă din prima sferă de solvatare și pentru alte molecule de apă. Numărul de solvabilitate n este apoi obținut ca un raport al suprafețelor vârfurilor respective. Moleculele de apă prezente în a doua sferă de solvatare fac schimb rapid cu moleculele solventului, dând naștere la mici variații ale deplasării chimice a moleculelor de apă necoordonate în raport cu apa solventului. Principalul dezavantaj al acestei metode este necesitatea utilizării unor soluții destul de concentrate, cu riscul de a forma perechi ionice cu anionul.
Numere de rezolvare determinate de RMN [11] ion n nucleu Fii peste 2 ani 4 1 H 17 O Mg 2+ 6 1 H Zn 2+ 6 1 H La 3+ ani 6 1 H 17 O Ga 3+ 6 1 H 17 O În 3+ 6 1 H Fe 2+ 6 17 O Co 2+ 6 1 H Ni 2+ 6 1 H 17 O Th 4+ 9 1 H
difracție cu raze X
Într-o soluție care conține apă, nu există o ordine pe termen lung într-un cristal care conține aceiași ioni, dar există încă o ordine pe termen scurt. Difracția cu raze X a unei soluții asigură o funcție de distribuție radială din care poate fi derivat numărul de coordonare al ionului metalic și distanța metal-oxigen. Pentru aquoions foarte încărcați, informații pot fi obținute și despre a doua sferă de solvatare. [12] [13]
Această tehnică necesită utilizarea unor soluții relativ concentrate. Razele X sunt împrăștiate de electroni și, prin urmare, puterea de împrăștiere crește odată cu numărul atomic . În consecință, atomii de hidrogen sunt aproape invizibili în măsurătorile cu raze X.
Tehnica difracției cu raze X cu unghi larg (WAXD) a fost utilizată pentru a caracteriza a doua sferă de solvabilitate în ioni trivalenți precum Cr 3+ și Rh 3+ . S-a găsit că a doua sferă de solvatare Cr 3+ conține 13 ± 1 molecule situate la o distanță medie de 402 ± 20 pm de la metalul central. Aceasta implică faptul că fiecare moleculă de apă a primei sfere de solvatare este hidrogen legat de două molecule ale celei de-a doua sfere. [14]
Difracția neutronică
Difracția neutronică asigură, de asemenea , o funcție de distribuție radială. Spre deosebire de difracția cu raze X, neutronii sunt împrăștiați din nuclee și nu există nicio relație cu numărul atomic. [15] Cu toate acestea, se poate exploata faptul că împrăștierea neutronilor este puternic dependentă de izotopul particular al unui element dat. Într-un experiment clasic, s-au efectuat măsurători pe patru soluții de clorură de nichel care conțin diverse combinații de izotopi 58 Ni, 60 Ni, 35 Cl și 37 Cl pentru a obține o descriere detaliată a cationului și a solvației anionice. [16] Datele colectate pentru diferite săruri arată o anumită dependență de concentrația soluției.
Numărul de rezoluție al cationului determinat de difracția neutronică [17] Cation Anion Concentrație (a)
(mol kg −1 )Un numar de
solvatareLi + Cl - 27,77 2.3 (2) (b) 9,95 3,0 (5) 3,57 5.5 (3) Ca 2+ Cl - 4.49 6.4 (3) 2,80 7.2 (2) 1.0 10,0 (6) Ni 2+ Cl - 3.05 5.8 (2) 0,85 6.6 (5) 0,46 6.8 (8) 0,086 6.8 (8) Ni 2+ ClO - 4 3,80 5.8 (2) Cu 2+ ClO - 4 2.00 4.9 (3) Fe 3+ NU - 3 2.0 5,0 (2) Nd 3+ Cl - 2,85 8.5 (2) Dy 3+ Cl - 2.38 7.4 (5)
- Note: (a) moli de dizolvat per kg de solvent; (b) numerele dintre paranteze sunt abaterile standard de la ultima cifră semnificativă a valorii date.
Majoritatea acestor date se referă la soluții concentrate care conțin foarte puține molecule de apă care nu se află în prima sferă de hidratare a cationului sau a anionului; acest lucru poate justifica unele variații ale numărului de solvabilitate, deoarece concentrația variază chiar dacă nu există perechi ionice în contact.
Numărul de solvabilitate măsurat este calculat în timp pe întreaga soluție. Când numărul este fracțional, există două sau mai multe specii în echilibru între ele, fiecare cu un număr întreg de solvabilitate. Acest raționament se aplică și numerelor de solvatare întregi, în cadrul erorii experimentale. De exemplu, numărul de solvabilitate 5,5 pentru una dintre soluțiile de clorură de litiu poate fi interpretat ca prezența a două soluții apoase diferite, cu concentrații similare:
- [Li (H 2 O) 6] + ⇄ [Li (H 2 O) 5] + + H 2 O
O altă posibilitate este formarea unei perechi de ioni datorită interacțiunii cationului solvatat cu un anion, care este foarte probabil atunci când sunt examinate soluțiile concentrate. De exemplu, numărul de solvabilitate 3 pentru una dintre soluțiile de clorură de litiu ar putea rezulta din echilibru
- [Li (H 2 O) 4 ] + + Cl - ⇄ [Li (H 2 O) 3 Cl] + H 2 O
s-a deplasat complet spre dreapta în favoarea perechii de ioni.
Spectre vibraționale
Atât spectroscopia în infraroșu, cât și spectroscopia Raman pot fi utilizate pentru a măsura frecvențele de întindere în aquoions. Spectroscopia Raman este deosebit de utilă deoarece spectrul Raman al apei este slab în timp ce spectrul infraroșu al apei este intens. Interpretarea frecvențelor vibrațiilor este complicată în ioni tetraedric și octaedric datorită prezenței a două moduri de vibrație, unul simetric observabil în spectrul Raman și unul asimetric observabil în spectrul infraroșu.
Vibrații de întindere simetrice MO pentru unele soluții apoase în soluție [18] Ion metalic număr de undă (cm −1 ) Fii peste 2 ani 530-543 Mg 2+ 360-365 Mn 2+ 395 Fe 2+ 389 Ni 2+ 405 Cu 2+ 440 Zn 2+ 385-400 Hg 2+ 380 [19] La 3+ ani 520-526 Ga 3+ 475 În 3+ 400
Deși nu există o relație simplă între frecvența vibrațiilor și constanta forței , datele raportate ne permit să tragem concluzia generală că puterea legăturii M - O crește odată cu creșterea încărcăturii ionice și scăderea dimensiunii ionului. Frecvențele de întindere M-O pentru un ion acvatic în soluție pot fi comparate cu valorile respective obținute în cristale cu structură cunoscută. Dacă valorile frecvenței sunt foarte similare, se poate concluziona că numărul de coordonare al ionului metalic este același în soluție și în stare solidă.
Metode dinamice
Mișcarea ionilor în soluție poate fi studiată prin măsurători de conductivitate , mobilitate și difuzie . Când un ion se deplasează printr-o soluție, tinde să tragă atât prima, cât și a doua sferă de solvatare cu ea. Din acest motiv, numerele de solvabilitate obținute cu metode dinamice tind să fie mult mai mari decât cele obținute cu metode statice.
Numere de rezolvare obținute prin metode dinamice [20] Li + Na + Cs + Mg 2+ Ca 2+ Ba 2+ Zn 2+ Cr 3+ La 3+ ani Numărul de transport 13-22 7-13 4 12-14 8-12 3-5 10-13 Mobilitate ionică 3-21 2-10 10-13 7-11 5-9 10-13 Difuzie 5 3 1 9 9 8 11 17 13
Numere și structuri de rezolvare
Metale alcaline
Numerele de rezolvare în intervalul 3-6 au fost observate pentru acvaiul cu litiu . Valorile mai mici de 4 se pot datora formării perechilor ionice în contact. Valorile superioare pot fi interpretate având în vedere moleculele de apă care se apropie de fețele tetraedrului format de ionul [Li (H 2 O) 4 ] + , chiar dacă simulările de dinamică moleculară indică existența posibilă a unui ion octaedric [Li (H 2 O) 6 ] + . [21] Ionul Na + are cel mai probabil șase molecule de apă în prima sferă de solvatare. Pentru ionii de potasiu , rubidiu și cesiu , prima sferă de solvatare este de asemenea slab definită. [22]
Metale alcalino-pământoase
Beriliul are o primă sferă de solvatare foarte bine definită, cu patru molecule de apă; specia [Be (H 2 O) 4 ] 2+ are o geometrie tetraedrică. [23] Specia de magneziu [Mg (H 2 O) 6 ] 2+ este, de asemenea, bine caracterizată, cu geometrie octaedrică. Pentru fotbal, situația este mai complicată. Datele privind difracția neutronică indică faptul că pentru clorura de calciu numărul de solvabilitate depinde foarte mult de concentrație: se găsește 10,0 ± 0,6 la concentrația de 1 mol dm −3 , iar valoarea scade la 6,4 ± 0, 3 până la 2,8 mol dm −3 . Raza de lovitură exacoordonată a lui Shannon este 100 pm comparativ cu 72 pm de magneziu, cu o creștere de 28%; acest lucru face posibilă un număr mai mare de solvabilitate, în timp ce densitatea de încărcare mai mică ( z 2 / r ) face legăturile M - O mai slabe, facilitând formarea perechilor ionice. Se cunosc diferiți hidrați solizi în care calciul are opt coordonări cu geometria antiprismului de tip pătrat și dodecaedru . [24] S-a determinat un număr de solvabilitate de 8,1 ± 0,3 pentru stronțiu și bariu apos, cu distanțe Sr - O = 263 pm și Ba - O = 281 pm . [25]
Metale din grupa 3 , lantanide și actinoide
Există acum diferite dovezi indirecte că scandiul (III) aqua ion conține șapte molecule de apă. [26] Ionul de itriu (III) are aproximativ aceeași rază Shannon ca holmiu (III) și proprietăți similare; ionul său acvatic probabil conține opt molecule de apă. Apa de lantan (III) ar trebui să conțină nouă, asemănătoare cu lantanidele mai ușoare.
Ionii trivalenți ai lantanidelor au dimensiuni în scădere regulată care trec de la lantan la luteci ; acest efect este cunoscut sub numele de contracție lantanoidă . Cu toate acestea, există dovezi puternice că numărul de hidratare scade de la 9 la 8 în jurul gadolinului . [27] În stare solidă, cele mai frecvente structuri ale acestor aquoions sunt prisma trigonală trigonală pentru nouă coordonare în lantanoizi mai ușori și antiprisma pătrată pentru opt coordonări în lantanoizi mai grei. Cu toate acestea, nu există date experimentale pentru solvatarea ceriului (IV) și a europiului (II), singurii ioni lanoizi comuni cu un număr de oxidare diferit de +3. [28]
Pentru actinoizi în starea de oxidare +3 și +4 se presupune un număr de solvabilitate de 9 sau mai mult, dar datele experimentale sunt cunoscute numai pentru toriu (IV).
Tranziția și gruparea 12 metale
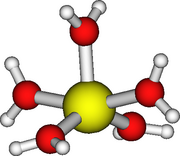
Aquoion-urile acestor metale în starea de oxidare +2 și +3 au numărul de solvabilitate 6. Toate au o structură octaedrică regulată, cu excepția aquoionilor de crom (II) și cupru (II) care sunt supuse distorsiunii Jahn -Teller . [30] În cazul cuprului în stare solidă, rezultă cele două distanțe axiale Cu - O 238 pm , în timp ce cele patru distanțe ecuatoriale Cu - O sunt 195 pm . [31] Cu toate acestea, există date experimentale contradictorii în soluție și nu este clar dacă numărul de solvabilitate al cuprului (II) este 5 sau 6. [30] Argintul (I) este probabil tetracoordonat, [Ag (H 2 O) 4 ] + . [32]
Un număr de solvatare 6 cu structură octaedrică este bine demonstrat pentru zinc (II) și cadmiu (II) apos în soluție diluată. În soluție concentrată ionul Zn 2+ poate fi tetracoordonat cu o structură tetraedrică, dar acest lucru s-ar putea datora formării perechilor de ioni sau reacțiilor de hidroliză. [33]
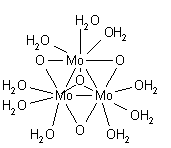
Pentru mercur (II) cel mai probabil număr de solvabilitate este 6. [34] Ion mercur (I) are structura [(H 2 O) -Hg-Hg- (OH 2 )] 2+ , determinată atât în solid, cât în soluție . [35] [36] Un alt aqua ion care conține o legătură (cvadruplă) metal-metal este specia molibden (II) [(H 2 O) 4 -Mo≣Mo- (OH 2 ) 4 ] 4+ . [37] Fiecare molibden este înconjurat de patru molecule de apă cu o geometrie plană pătrată, cu o structură similară cu cea cunoscută pentru complexul [Mo 2 Cl 8 ] 4– ; cu toate acestea, prezența unei a cincea molecule de apă într-o poziție axială nu poate fi exclusă. [35]
În a doua și a treia serie de tranziție există foarte puțini acvoi cu număr de oxidare +2 sau +3. În starea de oxidare +4 există doar specii hidrolizate.
Metale din grupele 13 , 14 și 15
Apa de aluminiu , [Al (H 2 O) 6 ] 3+ este foarte bine caracterizată atât în stare solidă, cât și în soluție. Miezul AlO 6 are simetrie octaedrică. Acvaiile de galiu (III), indiu (III) și taliu (III) au, de asemenea, numărul de solvabilitate 6. Se presupune că ionul acvatic de taliu (I) este hexacoordonat, dar nu există teste experimentale valide. [38] Raza Shannon a lui Tl + este 150 pm , nu mult diferit de cel al lui K + , 138 pm , deci unele asemănări chimice între Tl + și K + sunt previzibile și au fost observate. [39]
Numărul de solvabilitate al ionului de apă de staniu (II), [Sn (H 2 O) n ] 2+ , nu este cunoscut tocmai datorită hidrolizei prezente în soluțiile concentrate necesare pentru măsurători de împrăștiere cu raze X. [40] Același lucru este adevărat pentru aquaionul de plumb (II).
În bismut (III) există dovezi indirecte pentru un număr de solvatare 9. În stare solidă a fost caracterizată o specie nonhidratată, cu o structură de prismă trigonală tricapată. Raza Shannon pentru noua bismut de coordonare este 115 pm , comparabil cu cel al neodimului ( 116.3 pm ) pentru care numărul de solvabilitate 9 este bine stabilit. [41]
Achiziție osoasă
Când starea de oxidare devine mai mare de +3 unele elemente formează specii apoase care conțin liantul osos. Două exemple binecunoscute sunt ionii vanadil (IV) și uranil (VI). Formarea acestor specii poate fi văzută ca urmare a unei reacții de hidroliză de tip ipotetic
- [V (H 2 O) 6 ] 4+ → [VO (H 2 O) 5 ] 2+ + 2H +
Vanadiul are o coordonare octaedrică distorsionată ( simetrie C 4v ), înconjurată de cinci molecule de apă și un ion oxid. [42] La pH mai mic de 2, se crede că vanadiul (V) există ca ion dioxid [VO 2 (H 2 O) 4 ] + , dar dovezile depind de studii asupra complexelor cu liganzi oxalat , în care există stare solidă VO 2 + unitate, cu cele două legături V - O în cis . [43] . Structura acțiunii cromului (IV), [CrO (H 2 O) 5 ] 2+ , similar cu analogul vanadiului, a fost propusă pe baza dovezilor indirecte. [44]
Ionul uranil UO 2 2+ are o structură trans . Pe baza dovezilor indirecte se presupune că ionul acvatic are cinci molecule de apă în plan perpendicular pe axa O - U - O, astfel încât să formeze o structură bipiramidică pentagonală, simetrie D 5h . Cu toate acestea, planul ecuatorial ar putea conține și șase molecule de apă, formând o bipiramidă hexagonală, simetrie D 6h , deoarece sunt cunoscuți mulți complexe cu această structură. [45] Metoda de solvatare a ionului plutonil PuO 2 2+ nu este cunoscută.
Termodinamica
În contextul acvoiilor, termodinamica își propune să obțină date termodinamice asupra ionilor individuali, cum ar fi entalpia și entropia de hidratare. Aceste cantități se referă la reacție
- M z + (gaz) + solvent → M z + (în soluție)
Entalpia acestei reacții nu este direct măsurabilă, deoarece toate soluțiile care conțin săruri conțin inevitabil atât cationi, cât și anioni. Majoritatea măsurătorilor experimentale determină căldura dezvoltată atunci când o sare este dizolvată în apă și, în acest fel, se obține suma entalpiei de solvatare a cationului și a anionului. Ulterior, pentru a obține valorile ionilor individuali, se iau în considerare datele obținute pentru anioni diferiți cu același cation și datele pentru cationi diferiți cu același anion, stabilind un zero arbitrar.
Entalpia standard de hidratare a ionilor simpli (kJ / mol) [46] Li +
-514,6Fii peste 2 ani
-2487.0Na +
-404,6Mg 2+
-1922.1La 3+ ani
-4659,7K +
-320,9Ca 2+
-1592,4Sc 3+
-3960.2... Ga 3+
-4684,8Rb +
-296.2Sr 2+
-1444,7Y 3+
-3620.0... În 3+
-4108.7Sn 2+
-1554,4Cs +
-263.2Ba 2+
-1303,7Cele 3+
-3282,8... Tl 3+
-4184.0Pb 2+
-1479,9
Alte valori sunt Zn 2+ -2044,3; Cd 2+ -1805,8; Ag + -475,3 kJ / mol.
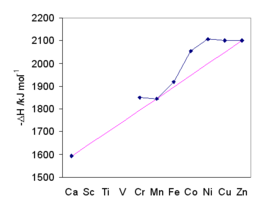
Există o corelație liniară excelentă între entalpia de hidratare și raportul dintre sarcina ionului pătrat, z 2 și distanța M - O, r eff . [47]
Valorile obținute pentru metalele de tranziție sunt totuși influențate de energia de stabilizare a câmpului cristalin (CFSE). În figură, tendința generală este prezentată de linia de culoare magenta care trece prin ionii Ca 2+ , Mn 2+ și Zn 2+ , pentru care nu există stabilizare în câmpul de cristal octaedric. Energia de hidratare crește odată cu scăderea dimensiunilor ionice, iar CFSE ajută la stabilizarea acvaiilor; stabilizarea maximă apare pentru Ni 2+ . Acordul valorilor entalpiei de hidratare cu predicțiile a fost un factor care a ajutat la validarea teoriei câmpului cristalin . [48]
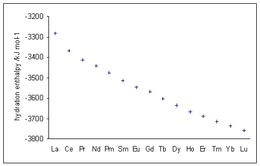
Pentru ionii trivalenți ai lantanidelor, se observă valori de hidratare a entalpiei care sunt din ce în ce mai negative pe măsură ce numărul atomic crește, în conformitate cu scăderea razei ionice ( contracția lantanoidă ).
De asemenea, este posibil să se obțină valorile entropiei de hidratare a ionilor individuali; datele sunt prezentate în tabelul următor. Cu cât valoarea este mai negativă, cu atât formarea acvaiului produce ordine în soluție. Se poate observa că metalele alcaline mai grele au valori de entropie destul de mici, sugerând că atât prima, cât și a doua sferă de solvatare sunt oarecum indistincte.
Entropie standard de hidratare cu un singur ion la 25 ° C (J deg -1 -1 mol -1 ) [49] Li +
-118,8Na +
-87,4Mg 2+
-267,8La 3+ ani
-464,4K +
-51,9Ca 2+
-209.2... Ga 3+
-510,4Rb +
-40,2Sr 2+
-205,0... În 3+
-426,8Cs +
-36,8Ba 2+
-159,0Cele 3+
-368,2...
Hidroliza acvoiilor
Apa în soluție poate da naștere la reacții de hidroliză. Există diferite moduri de a descrie acest proces; cel mai simplu este să se ia în considerare echilibrele de disociere în care ionii H + sunt eliberați treptat. Aceasta înseamnă, de asemenea, că toți cei apoși în soluție prezintă un grad de aciditate mai mult sau mai puțin ridicat. [50] Primul dintre aceste procese poate fi scris ca
- [M (H 2 O) n ] z + - H + ⇄ [M (H 2 O) n-1 (OH)] (z-1) +
și rezultă constanta de echilibru relativă a primei hidrolize
- [[M (OH)] {(z-1) + ] = K 1, -1 [M z + ] [H + ] −1
Studiul diferitelor reacții de hidroliză care au loc în soluție se bazează în general pe măsurarea constantelor de echilibru respective pornind de la măsurători de titrare potențiometrice ale pH-ului. Procesul este departe de a fi simplu din mai multe motive. [51] Uneori, speciile în soluție pot fi precipitate ca sare pentru a-și confirma structura prin cristalografie cu raze X. În alte cazuri, sărurile precipitate nu au nicio relație cu structura ipotetică în soluție, deoarece o anumită substanță cristalină poate avea o solubilitate foarte scăzută. și să fie prezent în soluție în concentrație foarte scăzută.
Odată ce s-a măsurat un număr mare de prime constante de hidroliză, s-a găsit o relație liniară între logaritmul constantei și raportul dintre sarcina ionului ( z ) și distanța M - O ( d ). Diferitii ioni pot fi grupați în patru grupuri. Panta liniei de regresie este aceeași pentru cele patru grupuri, dar interceptarea A este diferită. [52]
log K 1, -1 = A + 11,0 z / d cation LA Mg 2+ , Ca 2+ , Sr 2+ , Ba 2+
La 3+ , Y 3+ , La 3+-22,0 ± 0,5 Li + , Na + , K +
Fii 2+ , Mn 2+ , Fe 2+ , Co 2+ , Ni 2+ , Cu 2+ , Zn 2+ , Cd 2+
Sc 3+ , Ti 3+ , V 3+ , Cr 3+ , Fe 3+ , Rh 3+ , Ga 3+ , In 3+
Ce 4+ , Th 4+ , Pa 4+ , U 4+ , Np 4+ , Pu 4+ ,-19,8 ± 1 Ag + , Tl +
Pb 2+
Ti 3+ , Bi 3+ ,-15,9 ± 1 Sn 2+ , Hg 2+ , Pd 2+ aprox. 12
Cationii care au o tendință mai mică de hidrolizare sunt, în general, ioni sau lantanide metalice pre-tranziție (plus Al 3+ ); toate speciile din acest grup sunt clasificate ca acizi duri pe baza mărimii și încărcăturii. A doua grupă include ionii metalului alcalin și ai metalelor de tranziție, care sunt oarecum mai puțin rezistenți la hidroliză. Al treilea grup conține în principal ioni moi post-tranziție. În cele din urmă, ionii care au cea mai mare tendință de hidrolizare sunt Sn 2+ , Hg 2+ și Pd 2+ . [52]
Reacții multiple de hidroliză
I processi di idrolisi possono essere molto più complicati del semplice rilascio di uno ione H + , come visto in precedenza, e si arriva spesso alla formazione di specie polinucleari. Le reazioni del berillio esemplificano molte caratteristiche delle reazioni di idrolisi multipla. La figura a lato mostra come varia la concentrazione di varie specie in funzione del pH, passando attraverso specie polinucleari fino ad arrivare alla precipitazione dell'idrossido insolubile. L'idrolisi del berillio è inusuale perché la concentrazione di [Be(H 2 O) 3 (OH)] + è troppo piccola per essere misurata. Si ha invece la formazione del trimero [Be 3 (H 2 O) 6 (OH) 3 ] 3+ , la cui struttura è stata confermata in sali solidi. La formazione di specie polinucleari è favorita dalla riduzione della densità di carica che si ottiene nella molecola nel suo complesso. Attorno ad ogni ione berillio si ha una coordinazione tipo [Be(H 2 O) 2 (OH) 2 ] + . La riduzione di carica effettiva rilascia energia libera dato che c'è un aumento di entropia dovuto al maggior disordine della soluzione. [53]
Struttura di alcuni prodotti di idrolisi polinucleari. Le molecole d'acqua direttamente coordinate al metallo sono omesse [54] Specie Cationi Struttura M 2 (OH) + Be 2+ , Mn 2+ , Co 2+ , Ni 2+
Zn 2+ , Cd 2+ , Hg 2+ , Pb 2+un singolo ione idrossido a ponte tra due cationi M 2 (OH) (2z-2)+ 2 Cu 2+ , Sn 2+
Al 3+ , Sc 3+ , Ln 3+ , Ti 3+ , Cr 3+
Th 4+
VO 2+ , UO 2+ 2 , NpO 2+ 2 , PuO 2+ 2due ioni idrossido a ponte tra due cationi M 3 (OH) 3+ 3 Be 2+ , Hg 2+ anello a sei termini con gruppi M n+ e OH − alternati M 3 (OH) (3z-4)+ 4 Sn 2+ , Pb 2+
Al 3+ , Cr 3+ , Fe 3+ , In 3+cubo con vertici alternati di gruppi M n+ e OH − , con un vertice mancante M 4 (OH) 4+ 4 Mg 2+ , Co 2+ , Ni 2+ , Cd 2+ , Pb 2+ cubo con vertici alternati di gruppi M n+ e OH − M 4 (OH) 8+ 8 Zr 4+ , Th 4+ quadrato di ioni M n+ con due ioni idrossido a ponte su ciascun lato del quadrato
Il prodotto di idrolisi dell' alluminio di formula [Al 13 O 4 (OH) 24 (H 2 O) 12 ] 7+ è molto ben caratterizzato e può essere presente in acque naturali a pH circa 5,4. [55]
La reazione complessiva per il rilascio di due protoni da un acquoione si può scrivere come
- [M(H 2 O) n ] z+ - 2 H + ⇄ [M(H 2 O) n-2 (OH) 2 ] (z-2)+
Tuttavia, la stessa costante per il rilascio di due protoni vale anche per l'equilibrio
- [M(H 2 O) n ] z+ - 2 H + ⇄ [MO(H 2 O) n-2 ] (z-2)+ + H 2 O
dato che la concentrazione dell'acqua si assume sia costante. Questo è valido in generale: la costante di equilibrio è la stessa sia che il prodotto di idrolisi contenga uno ione ossido sia che contenga due ioni idrossido. Le due possibilità possono essere distinte solo determinando la struttura del sale allo stato solido. I ponti osso si formano più facilmente quando lo stato di ossidazione del metallo è elevato. [56] Un esempio di ponti osso è dato dal complesso di molibdeno (IV) [Mo 3 O 4 (H 2 O) 9 ] 4+ che contiene tre atomi di molibdeno connessi da legami σ ai vertici di un triangolo, mentre c'è un ponte osso sopra ciascun lato del triangolo, e un quarto ione osso è a ponte su tutti e tre gli atomi di molibdeno. [57]
Ossoanioni
Ci sono pochissimi osso acquoioni con metalli nello stato di ossidazione +5 o superiore, dato che avrebbero una carica troppo elevata per essere stabili. In soluzione acquosa si formano invece ossoanioni monomerici o polimerici. Gli ossoanioni possono essere considerati come i prodotti finali dei processi di idrolisi: dopo che tutti i protoni sono stati persi, rimangono attaccati al metallo solo gli ioni ossido.
Cinetica della reazione di scambio
Una molecola d'acqua presente nella prima sfera di solvatazione di un acquoione può scambiarsi di posto con una molecola d'acqua nel corpo della soluzione. In genere si considera che lo stadio cineticamente determinante sia la reazione di dissociazione
- [M(H 2 O) n ] z+ → [M(H 2 O) n-1 ] z+ * + H 2 O
Il simbolo * significa che questo è lo stato di transizione della reazione. La velocità della reazione è proporzionale alla concentrazione dell'acquoione, [A].
- .
La costante di proporzionalità k è una costante di velocità di primo ordine valida alla temperatura T. In genere questa costante di velocità per lo scambio di acqua è espressa nelle unità mol dm −3 s −1 . Il tempo di dimezzamento di questa reazione è log e 2 / ke dimensionalmente è un tempo. Questa misura risulta utile perché è indipendente dalla concentrazione. La quantità 1/k, uguale al tempo di dimezzamento diviso 0,6932 è nota come tempo di residenza o costante di tempo . [58]
Il tempo di residenza di una molecola d'acqua nella prima sfera di solvatazione può variare da circa 10 −10 s per Cs + a circa 10 +10 s (più di 200 anni) per Ir 3+ . Ciò dipende da fattori come dimensioni e carica dello ione, e nel caso di ioni dei metalli di transizione anche da effetti del campo cristallino . Reazioni molto veloci o molto lente sono difficili da studiare, e la maggior parte delle informazioni cinetiche sulle reazioni di scambio di acqua sono state ottenute da sistemi dove il tempo di residenza è compreso tra 1 μs and 1 s. Misurando le variazioni del tempo di residenza in funzione della temperatura si possono ricavare l'entalpia e l'entropia di attivazione, ΔH ‡ and ΔS ‡ .
Alcuni parametri cinetici per la reazione di scambio d'acqua a 25 °C [59] ione tempo di residenza
(μs)ΔH ‡
(kJ mol −1 )ΔS ‡
(J deg −1 mol −1 )Be 2+ 1,0 × 10 3 - Mg 2+ 2,0 43 8 V 2+ 1,3 × 10 4 - 69 21 Cr 2+ 0,0032 13 -13 Mn 2+ 0,0316 34 12 Fe 2+ 0,32 32 -13 Co 2+ 0,79 33 -17 Ni 2+ 40 43 -22 Cu 2+ 5,0 × 10 −4 - 23 25 Zn 2+ 0,032 Al 3+ 6,3 × 10 6 - 11 117 Ti 3+ 16 26 -63 Cr 3+ 2,0 × 10 12 - 109 0 Fe 3+ 316 37 -54 Ga 3+ 501 26 -92 Rh 3+ 3,2 × 10 13 - 134 59 In 3+ 50 17 La 3+ 0.050 U 2+ 2 1,3
Nei metalli di transizione i parametri sono influenzati dalla energia di stabilizzazione del campo cristallino (CFSE), sia per quanto riguarda l'acquoione sia per i suoi prodotti di dissociazione che hanno perso una o più molecole d'acqua dalla prima sfera di solvatazione. Questo spiega la particolare inerzia (tempo di residenza lungo) delle specie ottaedriche Cr 3+ (configurazione elettronica d 3 ), Rh 3+ e Ir 3+ (entrambi d 6 ); in questi casi il livello d è pieno o semipieno conferendo una particolare stabilità. Gli ioni trivalenti hanno tempo di residenza più lungo dei divalenti, tranne che per lantanoidi molto grandi. I valori nella tabella mostrano che ciò è dovuto sia all'entalpia che all'entropia di attivazione. [60]
Meccanismi
L'assegnazione del meccanismo della reazione di scambio dell'acqua è particolarmente complessa, essendo un caso particolare di reazione di sostituzione dei leganti . Il semplice meccanismo dissociativo deve essere modificato per tener conto della presenza della seconda sfera di solvatazione. In ogni caso lo scambio tra le molecole nella seconda sfera e l'acqua nel corpo della soluzione è veloce rispetto allo stadio cineticamente determinante. Ci sono tre meccanismi possibili: [61]
- I d (meccanismo di interscambio dissociativo). Una molecola d'acqua esce dalla prima sfera di solvatazione e entra nella seconda sfera, mentre una molecola d'acqua è in arrivo dal corpo della soluzione, ma nello stato di transizione l'interazione più significativa è tra il metallo e la molecola uscente.
- I a (meccanismo di interscambio associativo). Si ha la stessa reazione di scambio, ma nello stato di transizione si ha una significativa interazione tra la molecola d'acqua in arrivo e lo ione metallico.
- A (meccanismo associativo). Si ha l'arrivo di una molecola d'acqua dal corpo della soluzione prima della dissociazione.
Questa classificazione descrive casi estremi; il meccanismo effettivo può avere un decorso intermedio. Il parametro più utile per distinguere tra i possibili meccanismi è la variazione del volume di attivazione, ΔV ‡ , che si ottiene da misure di velocità di reazione al variare della pressione. [62] [63]
Il volume di attivazione cresce in meccanismi dissociativi e cala in meccanismi associativi.
Note
- ^ Burgess 1978 , Sezione 1.2 .
- ^ Burgess 1978 , p. 20 .
- ^ Richens 1997 , p. 25 .
- ^ Burgess 1978 , p. 181 .
- ^ Shannon 1976
- ^ Burgess 1978 , Cap. 11 .
- ^ Burgess 1978 , Cap. 6 .
- ^ Chipperfield 1999
- ^ Mido et al. 2001
- ^ Stumm e Morgan 1995
- ^ Burgess 1978 , p. 53 .
- ^ Johansson 1992
- ^ Ohtaki e Radnai 1993
- ^ Magini 1988
- ^ Neilson e Enderby 1989
- ^ Neilson e Enderby 1983
- ^ Enderby 1987
- ^ Burgess 1978 , p. 85 .
- ^ Adams 1967 , p. 254 .
- ^ Richens 1997 , p. 40 .
- ^ Richens 1997 , p. 126 .
- ^ Richens 1997 , p. 127 .
- ^ Richens 1997 , p. 129 .
- ^ Richens 1997 , sez. 2.3 .
- ^ Persson et al. 1995
- ^ Richens 1997 , p. 176 .
- ^ Richens 1997 , p. 185 .
- ^ Richens 1997 , p. 198 .
- ^ Frank et al. 2005
- ^ a b Persson 2010
- ^ Richens 1997 , cap. 4 e 12 .
- ^ Richens 1997 , p. 521 .
- ^ Richens 1997 , p. 544 .
- ^ Richens 1997 , p. 555 .
- ^ a b Richens 1997 , p. 551 .
- ^ Rich 2007 , p. 296 .
- ^ Rich 2007 , p. 127 .
- ^ Richens 1997 , sez. 2.4 .
- ^ Greenwood e Earnshaw 1997 , p. 241 .
- ^ Richens 1997 , pp. 152-153 .
- ^ Richens 1997 , p. 157 .
- ^ Richens 1997 , p. 236 .
- ^ Richens 1997 , p. 240 .
- ^ Richens 1997 , p. 278 .
- ^ Richens 1997 , p. 202 .
- ^ a b c Burgess 1978 , p. 182 .
- ^ Richens 1997 , fig. 1.2 .
- ^ Orgel 1966
- ^ Burgess 1978 , p. 187 .
- ^ Cotton e Wilkinson 1988
- ^ Baes e Mesmer 1976 , cap. 3 .
- ^ a b Baes e Mesmer 1976 , p. 407 .
- ^ Baes e Mesmer 1976 , sez 18.2 .
- ^ Baes e Mesmer 1976 , Tab. 18.3 .
- ^ Richens 1997 , p. 145 .
- ^ Baes e Mesmer 1976 , p. 420 .
- ^ Richens 1997 , Fig. 6.26 .
- ^ Atkins e de Paula 2006 , cap. 22 .
- ^ Burgess 1978 , Tabelle 11.4 e 11.5 .
- ^ Burgess 1978 , p. 326 .
- ^ Burgess 1978 , p. 319 .
- ^ Burgess 1978 , p. 323 .
- ^ Richens 1997 , p. 74 .
Bibliografia
- ( EN ) DM Adams,Metal-Ligand and Related Vibrations , London, Edward Arnold, 1967.
- ( EN ) PW Atkins e J. de Paula, Physical Chemistry , 8ª ed., Oxford University Press, 2006, ISBN 0-19-870072-5 .
- ( EN ) CF Baes e RE Mesmer, The Hydrolysis of Cations , 2ª ed., Krieger, 1976, ISBN 0-89874-892-5 .
- ( EN ) J. Burgess, Metal ions in solution , Chichester, Ellis Horwood, 1978, ISBN 0-85312-027-7 .
- ( EN ) JR Chipperfield, Non-aqueous Solvents , Oxford University Press, 1999, ISBN 0-19-850259-1 .
- ( EN ) FA Cotton e G. Wilkinson,Advanced Inorganic Chemistry , 5ª ed., New York, Wiley-Interscience, 1988, ISBN 0-471-84997-9 .
- ( EN ) JE Enderby, Diffraction Studies of Aqueous Ionic Solutions , in M.-C. Bellisent-Funel e GW Neilson (a cura di), The Physics and Chemistry of Aqueous Ionic Solutions , Reidel, 1987, pp. 129-145, ISBN 90-277-2534-9 .
- ( EN ) P. Frank, M. Benfatto, RK Szilagyi, P. D'Angelo e altri, The Solution Structure of [Cu(aq)] 2+ and Its Implications for Rack-Induced Bonding in Blue Copper Protein Active Sites , in Inorg. Chem. , vol. 44, n. 6, 2005, pp. 1922–1933, DOI : 10.1021/ic0400639 .
- ( EN ) NN Greenwood e A. Earnshaw, Chemistry of the elements , 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 .
- ( EN ) G. Johansson, Structures of Compexes in Solution Derived from X-ray Diffraction Measurements , in Adv. Inorg. Chem. , vol. 39, 1992, pp. 159-232, DOI : 10.1016/S0898-8838(08)60260-3 .
- ( EN ) M. Magini (a cura di), X-ray diffraction of ions in aqueous solutions: hydration and complex formation , Boca Raton, CRC Press, 1988, ISBN 0-8493-6945-2 .
- ( EN ) Y. Mido, S. Taguchi, MS Sethi e SA Iqbal, Chemistry in Aqueous and Non-aqueous Solvents , New Delhi, Discovery Publishing House, 2001, ISBN 81-7141-331-5 .
- ( EN ) GW Neilson e JE Enderby, The Structure of an Aqueous Solution of Nickel Chloride , in Proc. R. Soc. Lond. A , vol. 390, n. 1799, 1983, pp. 353-371, DOI : 10.1098/rspa.1983.0136 .
- ( EN ) GW Neilson e JE Enderby, The Coordination of Metal Aquaions , in Adv. Inorg. Chem. , vol. 34, 1989, pp. 195-218, DOI : 10.1016/S0898-8838(08)60017-3 .
- ( EN ) LE Orgel, An Introduction to Transition-metal Chemistry: Ligand-field Theory , Methuen, 1966.
- ( EN ) I. Persson, M. Sandström e H. Yokoyama, Structure of the Solvated Strontium and Barium Ions in Aqueous, Dimethyl Sulfoxide and Pyridine Solution, and Crystal Structure of Strontium and Barium Hydroxide Octahydrate , in Zeitschrift für Naturforschung A , vol. 50, n. 1, 1995, pp. 21–37, DOI : 10.1515/zna-1995-0105 .
- ( EN ) H. Ohtaki e T. Radnai, Structure and dynamics of hydrated ions , in Chem. Rev. , vol. 93, n. 3, 1993, pp. 1157-1204, DOI : 10.1021/cr00019a014 .
- ( EN ) I. Persson, Hydrated metal ions in aqueous solution: How regular are their structures? , in Pure Appl. Chem. , vol. 82, n. 10, 2010, pp. 1901–1917, DOI : 10.1351/PAC-CON-09-10-22 .
- ( EN ) RL Rich, Inorganic Reactions in Water , 1ª ed., Berlino, Springer, 2007, DOI : 10.1007/978-3-540-73962-3 , ISBN 978-3-540-73961-6 .
- ( EN ) DT Richens, The Chemistry of Aqua Ions: Synthesis, Structure and Reactivity , Wiley, 1997, ISBN 0-471-97058-1 .
- ( EN ) RD Shannon, Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides , in Acta Cryst. , A32, 1976, pp. 751-767, DOI : 10.1107/S0567739476001551 .
- ( EN ) W. Stumm e JJ Morgan, Aquatic Chemistry: Chemical Equilibria and Rates in Natural Waters , 3ª ed., John Wiley & Sons, 1995, ISBN 0-471-51185-4 .





![{\displaystyle \mathrm {velocita'} =-\left({\frac {d[A]}{dt}}\right)_{T}=k[A]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/911c0e096f412ff3ad65ac02b04c49fa980003c4)
