Cancer tiroidian
| Cancer tiroidian | |
|---|---|
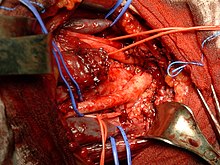
| Locul nodului tiroidian al cancerului. glanda, după ce a fost îndepărtată în întregime, a fost disecată în coincidență cu nodulul malign pentru a demonstra structura macroscopică internă a tumorii | |
| Specialitate | Endocrinologie, chirurgie generală |
| Etiologie | mutații în calea MAPKinase |
| Cartierul general afectat | glanda tiroida |
| Impact la nivel mondial | 1-5 / 100.000 |
| Clasificare și resurse externe (EN) | |
| MedlinePlus | 001213 |
| eMedicină | 851968 |
| Sinonime | |
| Cancer tiroidian | |
Tumorile tiroidiene pot fi benigne și maligne . Cancerul tiroidian este o boală relativ rară (1-2% din neoplasme), dar a crescut rapid în ultimii ani: în perioada 1973-2002 incidența a crescut cu 48% la bărbați și 67% la femei. [1]
Cel mai eficient tratament pentru cancerele tiroidiene agresive este îndepărtarea chirurgicală a glandei tiroide ( tiroidectomie ), urmată de ablație cu iod radioactiv 131 și terapie de supresie TSH . Astăzi, în cazurile de boală avansată, metastatică, progresivă și inoperabilă, se utilizează terapii țintă cu inhibitori ai kinazei (în principal Lenvatinib și Sorafenib ) [2] . Rolul radioterapiei rămâne valabil, în special pe unele metastaze, precum oasele sau creierul. În Statele Unite, ratele de supraviețuire pe cinci ani sunt de 97,8% [3] , dar studii recente arată că, în ciuda supraviețuirii bune, cei care au experimentat cancer tiroidian observă o scădere a calității vieții și manifestă simptome de suferință psihologică, cum ar fi anxietatea sau depresie [4] .
Anatomia chirurgicală și descriptivă a tiroidei

Tiroida este un organ neuniform și median, situat în regiunea mediană anterioară a gâtului . Se compune din doi lobi laterali, uniți printr-un istm neuniform și median.
Cei doi lobi au o formă conică cu baza inferioară, extinzându-se, la adult, pentru aproximativ 3 cm de la jumătatea înălțimii cartilajului tiroidian până la aproximativ al 5-lea inel traheal . Grosimea lobilor poate varia între 0,5 cm spre vârf și 2 cm spre bază. Istmul conectează cei doi lobi lângă baza lor și se aplică primelor două inele traheale. În jumătate din cazuri, o extensie glandulară pleacă de la marginea superioară a istmului, de formă și dimensiune foarte variabilă, care merge în sus spre stânga, ajungând la osul hioid și uneori depășindu-l spre rădăcina limbii. Acesta ia numele de lob piramidal sau piramida lui Morgagni și reprezintă o mărturie a drumului parcurs de glandă în timpul organogenezei sale. Uneori există o structură fibromusculară care leagă osul hioid de istm sau lobul piramidal, menționat în literatură ca un mușchi al tiroidei . [5] [6]
Tiroida este învelită de o teacă fibroasă (teacă peritiroidă), considerată a depinde de fascia cervicală mijlocie. Lăstarii fibroși se desfac din aceasta, acționând ca ligamente, care asigură organul de cartilajul tiroidian al laringelui (ligament suspensor sau median), de cartilajul cricoid al laringelui și de primele inele traheale (ligamente laterale interne) și de teacă fibroasă care conturează fasciculul vascular-nervos al gâtului (ligamente laterale externe). Glanda este adăpostită în interiorul acestei înveliș și, la rândul său, este protejată de o capsulă fibroasă care este atașată intim de organul însuși. În grosimea care separă capsula de teacă, se desfășoară o împletitură vasculară densă, afluentă a venelor și arterelor locale, care a dat zonei denumirea de „spațiu peritiroidian periculos”. De asemenea, în acest spațiu, pe aspectul posterior al glandei, sunt prezente glandele paratiroide . Dintre cele trei fețe (medială, anterolaterală și posterioară) mediala este concavă și îmbrățișează fața laterală a traheei și a cartilajelor cricoide și tiroidiene și, într-o manieră variabilă, a esofagului . Fața posterioară, mai puțin întinsă decât celelalte, se contractă cu carotida comună și deci cu vena jugulară internă, înfășurată în propria sa teacă. [5] [6]
Organul este atașat, posterior, la suprafața ventrală a cartilajului tiroidian („scutul tiroidian”) al laringelui și la primele două inele traheale. Ventral, este acoperit de mușchii subhioizi: în sens anteroposterior, de homoioid , de tiroidă și de sternotiroid . Datorită cursului oblic al acestor mușchi de-a lungul axei verticale a gâtului, o fereastră anatomică se deschide deasupra marginii superioare a sternului, unde glanda este descoperită de mușchi, cu excepția fascia cervicală mijlocie și superficială care, fuzionând, separă organ din piele. Acesta reprezintă reperul în care, în majoritatea cazurilor, este posibil să palpați și să detectați posibilele modificări ale tiroidei în timpul examinării fizice a pacientului. Bilateral, tiroida este acoperită de mușchii sternocleidomastoidieni și, mai superficial, de mănunchiurile mușchiului platismului gâtului. [5] [6]
Marginea externă a lobului stâng al tiroidei, posterior, se sprijină pe fața esofagiană ventrală, formând un ușor coridor prin care trece nervul recurent stâng. Datorită tuturor acestor structuri, tiroida este atașată cu tenacitate de axa laringotraheală, rezultând solidaritatea în mișcările acesteia din urmă. [5] [6]
Vascularizație și inervație
Tiroida este deservită de un sistem de patru artere : arterele tiroidiene superioare și inferioare (două pe fiecare parte); în timp ce este drenat prin șase vene : venele tiroidiene superioare, medii și inferioare (trei la număr pe fiecare parte).
Sistemul arterial
Arterele tiroidiene superioare dreapta și stânga sunt ramuri ale carotidei externe și ajung la organ de sus. Pe de altă parte, arterele tiroidiene din dreapta și stânga inferioare apar din trunchiul tirocervical al subclaviei respective și rulează de jos în sus. În un sfert de cazuri este posibil să se găsească o mică arteră tiroidiană ima, o ramură a arterei brahiocefalice sau a arterei carotide comune , care ajunge la organul de jos spre istm, care se desfășoară de-a lungul liniei mediane pe partea ventrală a trahee. [5] [6]
Descrierea punctului de ramificare a vaselor terminale ale arterei tiroidei inferioare are o importanță semnificativă: de fapt, la acest nivel, în apropierea polilor inferiori ai lobilor laterali ai tiroidei, rulează nervul recurent (sau laringian inferior) , ramură a nervului vag . Trece de jos în sus, de obicei într-un ochi vascular. Chirurgul ar trebui să acorde întotdeauna atenție acestei regiuni atunci când ligează vasul corespunzător.
Sistem venos
Drenajul venos are loc printr-o rețea densă situată în spațiul periculos, din care provin venele tiroidiene superioare și medii, care se drenează bilateral în venele jugulare interne, iar venele tiroidiene inferioare, afluente ale trunchiului brahiocefalic. [5] [6]
Inervație
Structurile nervoase de interes pentru regiunea chirurgicală tiroidiană sunt reprezentate de nervul laringian superior, mai exact de ramura sa externă și de cea inferioară. Nervul laringian superior provine din vag în apropierea ganglionului nodular, sub foramenul jugular, se deplasează în jos și înainte trecând în spatele arterei carotide interne și externe la originea lingualului; articulație la cornul superior al joidei, se bifurcă în ramurile interne și externe. Primul rulează pe mușchiul constrictor inferior al faringelui, acoperit de artera laringiană superioară, se insinuează între mușchii tiroidieni și membrana omonimă, pe care o traversează pentru a furniza inervația senzorială a mucoasei laringiene supraglotice și faringiene. Ramura externă, pe de altă parte, coboară vertical în apropierea inserției mediale a mușchiului constrictor inferior, aplicat acestuia din urmă, și ajunge la mușchiul cricotiroidian care inervează menținând în același timp tensiunea corzilor vocale ; leziunea sa implică, prin urmare, o reducere a tonusului și a forței vocale, compensată în mare parte de contralateral. După cum sa menționat cu precizie, ramura externă în cursul său se contractă cu artera tiroidiană superioară, care traversează anterior, plasându-se într-o poziție medială și anterioară față de ramura diviziunii arteriale anterioare. Nervul laringian inferior inferior sau recurent apare din marginea inferioară a gâtului din vag, chiar deasupra intersecției acestuia din urmă cu artera subclaviană, îl înconjoară pe aspectul anterior, inferior și posterior și se deplasează în sus și medial.
În stânga se ridică la nivel toracic, unde vagul traversează aspectul anterior al arcului aortic ; se reflectă în jurul arcului din față în spate și urmează un curs ascendent și medial, trecând în unghiul dintre arc în sine și ligamentul arterial pe fața anterioară a esofagului. La nivel cervical, nervul are un curs ascendent care converge spre trahee; unghiul dintre cursul nervului și marginea traheală este mai larg pe dreapta, deoarece reflexia nervului este mai laterală aici. Pe ambele părți, nervul traversează artera carotidă comună posterior și apare în regiunea cervicală în spațiul dintre trahee și arteră. Prin urmare, intersectează artera tiroidiană inferioară într-un mod extrem de variabil: pe trunchi (14%); la divizarea arterei în ramurile sale (11%); în corespondența ramurilor arteriale (75%). Metodele de încrucișare sunt făcute mai complexe de posibilitatea ca acest lucru să se întâmple în poziția retroarterială (47%), pre-arterială (28%) sau interarterială (25%). După o întindere liberă foarte scurtă, nervul se mișcă sub zona de aderență dintre glandă și trahee (ligamentul Gruber). Menținând această relație strânsă cu marginea și aspectul posterior al lobului, solicitantul ajunge la locul de intrare în laringe, situat la articulația crico-tiroidiană, posterior fațetei articulației, acoperit de mușchiul constrictor inferior al faringelui ( cricopharingian).
După cum sa menționat deja, la acest nivel, nervul este traversat de arteriole provenite din tiroida inferioară, care îngreunează pregătirea chirurgicală și, uneori, îi confundă cursul. Uneori, nervul recurent se împarte în două ramuri, foarte rar într-un număr mai mare, în general aproape sau chiar deasupra intersecției cu artera tiroidiană inferioară; în acest caz ramurile au un curs paralel rămânând destul de aproape de intrarea lor laringiană. Aproape constant laringianul inferior asigură o ramură cervicală, cu un curs ascendent și posterior, destinat inervației senzoriale și motorii a hipofaringelui , care se anastomozează cu o ramură corespunzătoare, provenind de la ramura externă a laringelui superior. Deși în mod necorespunzător, în utilizarea obișnuită a acestei anastomoze nervoase se atribuie numele nervului lui Galen, care aparține mai corect unei anastomoze intralaringiene între cei doi nervi laringieni. Laringele inferior generează 5 ramuri pe măsură ce trece profund în cartilajul tiroidian. În cursul lor, ramurile nervului recurent sunt situate adânc în scheletul cartilajului laringelui, oarecum expus la posibile traume care provin din lumenul căilor respiratorii (de exemplu, intubația orotraheală) datorită faptului că sunt conținute în acest structură rigidă. [5] [6]
Relațiile cu glandele paratiroide
Cunoașterea glandelor paratiroide și a relațiilor lor anatomo-topografice este indispensabilă în abordarea chirurgiei tiroidei. În general, la număr 4, glandele paratiroide sunt împărțite în superior și inferior. Cele superioare sunt situate aproximativ într-un cerc de 2,5 cm în diametru chiar deasupra punctului de intrare în glanda tiroidă a ramurilor arterei tiroide superioare; cele inferioare într-un cerc similar care include artera și zona de dedesubt. Mai precis, cele superioare, a căror așezare este mai constantă, sunt situate în porțiunea superioară a aspectului posterior al lobului, la înălțimea cartilajului cricoid și aproape de punctul de intrare al nervului laringian inferior în cricoid. [5] [6]
Cele inferioare, cu site mai inconstant, sunt plasate mai lateral, între fața posterioară și marginea laterală a tiroidei, la uniunea treimii mijlocii cu glanda inferioară, în strânsă legătură cu artera tiroidiană inferioară și nervul recurent. [7] . Cu o frecvență considerabilă există glande paratiroide ectopice și supranumerare; de fapt, cele inferioare pot fi adesea găsite în spațiul cervicomediastinal [8] .
Vase limfatice și stații de ganglioni limfatici
Drenajul limfatic al gâtului este dat de numeroase grupuri de ganglioni limfatici conectați între ei. Ganglionii limfatici cervicali, cufundați în țesutul celular liber interpus între benzile cervicale, se disting într-o rețea superficială și profundă, larg anastomozată între ele și cu o comunicare între cele două părți.
- Stații ganglionare superficiale: între fascia cervicală superficială și mijlocie, includ: ganglioni limfatici ai zonei interdigastrice, ganglioni limfatici ai zonei submandibulare, ganglioni limfatici ai zonei parotide, ganglioni limfatici ai zonei occipitale, ganglioni limfatici ai mastoidului sau retro zona auriculară, ganglionii limfatici ai grupului jugular anterior, ganglionii limfatici ai grupului venei jugulare externe.
- Stații profunde ale ganglionilor limfatici: 15-30, sunt situate sub fascia cervicală mijlocie și includ ganglionii limfatici:
- a lanțului ganglionar limfatic al triunghiului limfatic profund al regiunii laterale a gâtului: ganglionii limfatici ai lanțului jugular intern. Acestea sunt clasificate în ganglionii limfatici superiori, medii și inferiori. În dreapta dau canalul jugular care intră de obicei direct în vena jugulară internă la confluența dintre acesta și subclavian. În stânga afectează trunchiul jugular care curge în conducta toracică . Aceștia primesc limfa feței, ceafei și organelor spațiului visceral neuniform median.
- ganglionii limfatici ai accesoriului coloanei vertebrale. Există cinci până la zece ganglioni limfatici sateliți ai ramurii laterale a nervului cu același nume. Aceștia primesc limfa de la ganglionii limfatici occipital, retroauricular și suprascapular, spatele și părțile laterale ale scalpului, ceafă, regiunea laterală a gâtului și a umărului.
- ganglionii limfatici cervicali transversali. Acestea rulează de-a lungul arterei și venei transversale a gâtului. Ganglionul limfatic situat mai medial al acestui lanț se numește ganglionul limfatic Troisier. Aceștia primesc limfatice din lanțul nervos accesoriu spinal, din regiunile mamare și anterolaterale ale gâtului, din membrul superior.
- a compartimentului central sau juxtavisceral. Ceea ce sunt considerate stații primare ale organelor conținute în spațiul visceral neuniform median, sunt reprezentate de ganglionii limfatici situați în fața laringelui (prelaringian), a traheei (pretraheală) și a glandei tiroide (pretiroida), în spatele faringelui (retrofaringian), pe fețele laterale ale traheei (latero-traheală sau lanț recurent), ale mediastinului antero-superior.
Sistemul limfatic al glandei tiroide. O rețea limfatică densă își are originea în jurul foliculilor care curge, prin căile limfatice perilobulare, într-un sistem capsular și pericapsular, la rândul său, afluent al diferitelor stații. Colectorii limfatici de la marginea superioară de la marginea superioară a istmului ajung la ganglionul limfatic delfic din fața membranei cricotiroidiene. De aici, colectorii pentru grupul de ganglioni limfatici superiori și medii ai lanțului jugular intern se ramifică, conectați, la rândul lor, cu lanțul ganglionilor limfatici ai accesoriului spinal. Alți colectoare limfatice se ramifică de la marginea inferioară a istmului pentru a ajunge la lanțurile cervicale pretraheale, recurente și transversale. Acestea, la rândul lor, contractează relații cu colectoarele care provin din porțiunea postero-medială a lobilor tiroidieni.
Cea mai des utilizată clasificare împarte stațiile ganglionare limfatice ale gâtului în „compartimente”, utile din punct de vedere diagnostic, dar mai ales din punct de vedere terapeutic, în special în abordarea limfectomiilor [9]
- Ganglionii limfatici submentali (Ia) și submandibulari (Ib). Ganglionii limfatici submentali sunt incluși în țesutul fibroadipos situat superficial către mușchiul milo-joid, între marginea inferioară a mandibulei, marginile anterioare ale mușchilor sternocleidomastoidieni și un plan care trece prin corpul osului joid. Ganglionii limfatici submandibulari, pe de altă parte, înconjoară glanda salivară cu același nume.
- II ganglionii jugulari superiori jugulari, jugulo-digastrici și anteriori. Acestea sunt situate în jurul treimii superioare a venei jugulare interne, de la baza craniului până la un plan care trece prin osul joid. Limita anterioară este definită de mușchiul stilohoidian, în timp ce limita posterioară este definită de mușchiul sternocleidomastoidian. Acestea sunt împărțite la rândul lor în două grupuri, IIa și IIb, primul situat antero-medial la un plan vertical definit de nervul accesoriu spinal, al doilea situat postero-lateral la același plan.
- III ganglioni limfatici jugulari mijlocii . Sunt incluse între osul hioid superior și cartilajul cricoid inferior. Limita antero-medială a acestui nivel este reprezentată de marginea laterală a mușchiului hioid sternal, limita posterolaterală de marginea posterioară a mușchiului sternocleidomastoidian.
- IV ganglioni limfatici jugulari inferiori . Acestea sunt situate în treimea inferioară a venei jugulare interne, între cartilajul cricoid de deasupra și clavicula de dedesubt, între mușchiul sternotiroidian anterior și mușchiul sternocleidomastoidian posterior.
- V ganglionii limfatici accesorii mediali și inferiori. Acestea sunt incluse în triunghiul posterior al gâtului, delimitat de marginea posterioară a mușchiului sternocleidomastoidian de claviculă și de marginea anterioară a trapezului. Subnivelul Va include ganglionii limfatici accesorii spinali, în timp ce subnivelul Vb include ganglionii limfatici cervicali transversali și ganglionii limfatici supraclaviculari, cu excepția ganglionului limfatic Virchow , situat la nivelul IV.
- Ganglionii limfatici VI ai compartimentului central sau anterior. Sunt incluse în spațiul delimitat de teaca carotidă lateral, de osul hioid de deasupra și de crestătura sternală de dedesubt. Acestea includ ganglionii limfatici prelaringieni, pretraheali, peritiroidieni, paratraheali.
- VII ganglioni limfatici ai regiunii mediastinale. Include perirecorențialele inferioare și mediastinele superioare.
Deși nu sunt pe deplin incluse în ganglionii limfatici ai regiunii cervicale din punct de vedere strict anatomic, nivelul VII merită o mențiune importantă deoarece, împreună cu nivelul VI, reprezintă ganglionii limfatici cu cel mai mare risc de răspândire metastatică a cancerului tiroidian.
Tumori benigne
Acestea sunt noduli solitari ai tiroidei și pot provoca două tipuri de probleme: hipertiroidism și tulburări de compresie mecanică ale traheei sau esofagului . Acestea sunt asociate cu prognosticul benign, deoarece, spre deosebire de cele maligne, nu se răspândesc în tot corpul .
Prezentarea clinică a tumorii benigne este cea a nodulului tiroidian, care este în general studiat ultrasunografic, recunoscând unele caracteristici ale benignității sau suspiciunii de malignitate. Caracteristicile ultrasonografice ale benign sunt cistice aspect ( chistice noduli sunt aproape întotdeauna benigne), absența microcalcifications, regularitatea marginilor periferice, absența vascularizării intranodular la Doppler de putere , lipsa de creștere în timp. Pe scintigrafia tiroidiană , nodulul hipercaptant, așa-numitul nodul cald, se poate distinge de cel hipocaptic, așa-numitul nodul rece. Nodulii fierbinți sunt aproape întotdeauna benigni, cu toate acestea, pot da simptome de hipertiroidism cu tahicardie , boli de inimă până la insuficiență cardiacă , tulburări mentale și pierderea în greutate. Nodulul cald autonom a scăpat de controlul hipofizar, care nu poate fi suprimat cu terapia cu hormoni tiroidieni , dar care nu implică semne clinice de hipertiroidism în afară de scăderea TSH , trebuie să se distingă de nodulul franc „toxic” cu simptome de hipertiroidism și cardiotoxicoză ( adenom toxic de Plummer ).
Terapia adenomului toxic este chirurgicală (lobectomie), în timp ce radioterapia metabolică este rezervată cazurilor cu contraindicații sau refuzul intervenției chirurgicale. Nodulii reci corespund în general constatării citologice a leziunii foliculare (TIR3), care din păcate nu permite o anumită distincție între leziunea benignă (adenom folicular) și leziunea malignă (carcinomul folicular). Din acest motiv, în aceste cazuri, se recomandă terapia chirurgicală care permite, de asemenea, cu examenul histologic definitiv, un diagnostic de certitudine.
În mod normal, nodulul solid cu dimensiuni mai mici de 1 cm și fără caractere suspecte de ultrasunete este supus urmăririi clinice, de laborator și ultrasunete.
Bucata mai mare de un centimetru este supusă aspirării fine a acului și rezultatul va fi decisiv pentru alegerile ulterioare ale terapiei. Nodulii mari care, deși au un comportament benign, provoacă fenomene de compresie pe organele din apropiere care provoacă dispnee și / sau disfagie , sunt supuși tratamentului chirurgical.
Tumori maligne
Sunt tumori care, născute în glanda tiroidă, se pot răspândi pe tot corpul. Răspândirea tumorii poate apărea în trei moduri:
- prin contiguitate, structuri infiltrante apropiate de glanda tiroidă (traheea, esofagul, mușchii gâtului, nervul recurent);
- prin sistemul limfatic (metastaze la ganglionii limfatici din gât);
- prin vase de sânge (metastaze către organe îndepărtate, cum ar fi plămânul).
Această capacitate de difuzie este asociată cu un prognostic mai puțin favorabil sau „malign”. Din fericire, în afară de câteva forme rare cu un prognostic slab, majoritatea dintre ele, cu îngrijire adecvată, se recuperează. Cele mai frecvente forme nu sunt foarte agresive, deoarece sunt formate din celule foarte asemănătoare cu celulele sănătoase (sau diferențiate).
Epidemiologie
Incidenţă
În 2017, în Italia sunt de așteptat 15.300 de cazuri noi de cancer tiroidian, dintre care:
- 11.000 în rândul femeilor;
- 4.300 în rândul bărbaților. [10]
Prevalenta
AIRTUM (Asociația Italiană a Registrelor de Cancer) a înregistrat următoarele date despre cancerul tiroidian la populația italiană în perioada 2008-2013:
- 82% tumori papilare;
- 7% tumori foliculare;
- 3% tumori medulare;
- 1% tumori anaplazice.
Mortalitate
Decesele cauzate de cancerul tiroidian sunt extrem de scăzute, iar supraviețuirea este strâns corelată cu vârsta la diagnostic.
În 2014, în Italia au fost înregistrate 533 de decese, dintre care: [ fără sursă ]
- 317 femei;
- 216 bărbați.
Factori de risc
Oncologii italieni Giovanni Bernardo și Laura Locati au propus o clasificare a factorilor de risc pe baza etiologiei și a populației țintă: [10]
| Tumoare maligna | Natura și subtipurile de factor de risc | Etiologie | Patogenie | Populația țintă mai susceptibile |
|---|---|---|---|---|
| Carcinom diferențiat |
|
|
În cazuri de comorbiditate: asociere cu obezitate, tiroidită autoimună, boală tiroidiană nodulară (gușă) |
|
| Carcinom medular |
| Ambele sunt:
|
|
|
| Carcinom anaplastic | Indisponibil | Indisponibil | Indisponibil | Indisponibil |
Epidemiologia în alte națiuni
Cancerul tiroidian este cel mai frecvent cancer endocrin, aproximativ 1-1,5% din toate cazurile noi diagnosticate în fiecare an în SUA [11] . Incidența sa a crescut continuu în ultimele trei decenii în întreaga lume. Pe baza datelor, cancerul tiroidian este al cincilea cel mai frecvent cancer la femei [12] și, în Italia, este al doilea cel mai frecvent cancer la femeile sub 45 de ani [13] . Incidența a scăzut doar în foarte puține țări ( Norvegia și Suedia ).
Factorii genetici , influențele de mediu și accesul la îngrijiri medicale pot explica în mod exhaustiv diferențele geografice și etnice. Rapoarte recente au arătat că, deși cea mai scăzută rată de cancer tiroidian se observă la populația neagră, cea mai mare proporție de PTC apare la femeile negre [14] . Creșterea incidenței este aproape exclusivă formei PTC, fără o creștere semnificativă pentru formele foliculare, medulare sau anaplastice. În cele din urmă, creșterea se referă în principal la tumorile mici, deși și tumorile mari cresc ușor [15] .
Tablou clinic
Neoplasmul tiroidian, mai ales în stadiile incipiente, poate prezenta puține sau deloc simptome. Nodul carcinomatos, de fapt, crește fără a dezvolta neapărat caracteristici hiper- sau hipo-tiroidice, determinând procesiuni simptomatologice tipice care, în patologiile tiroidiene inflamatorii, duc la indicarea studiului glandei. Nodul tiroidian își arată prezența prin ocuparea spațiului, într-o perioadă care poate varia de la câteva luni (în cazul celor mai agresive tumori) până la zece ani. Pacienții vin în vizită din cauza așa-numitei „gușe”, o mărire localizată a regiunii gâtului, de obicei datorită creșterii nodulului sau, în caz de multifocalitate, unei măriri generalizate a țesutului glandular.
Aprecierea unui guș nu poate fi considerată un indicator specific și sensibil al patologiei neoplazice, deoarece hipertrofia și hiperplazia glandei sunt mecanismul celular normal de răspuns la orice patologie tiroidiană. În funcție de localizarea acestei umflături a gâtului, care poate fi superficială sau profundă, anterioară sau posterioară, va fi posibil ca medicul specialist să identifice masa prin procedurile normale de palpare în timpul examinării fizice. Palparea, întotdeauna bimanuală, are loc cu operatorul plasat în spatele pacientului, cu gâtul în extensie modestă, pentru a favoriza superficializarea structurilor glandulare. De asemenea, va fi posibil să se utilizeze ajutorul manevrei de înghițire (invitarea pacientului să bea o înghițitură de apă dintr-un pahar), ceea ce va permite diferențierea unei structuri aparținând glandei tiroide de una care provine din țesuturile vecine: în de fapt, în cazul unui nodul, datorită legăturii intime cu axa laringelui-traheală a glandei, acesta va urma ridicarea laringelui în timpul deglutiției, deplasându-se de sub mâinile operatorului. Astfel va fi posibil să se descrie o umflare nodulară circumscrisă, mobilă cu actele de înghițire, sau mai bine zis o mărire generalizată a parenchimului. De asemenea, va fi posibil să se descrie consistența umflăturii palpate, care de obicei, în caz de neoplazie, apare ca dur-lemn sau fibro-elastic. La repertazione di una massa non è che il primo step nel processo diagnostico necessario per inquadrare la malattia: infatti, l'esame obiettivo non è sufficiente per potere porre diagnosi, ma soltanto per indirizzare nell'iter diagnostico il medico.
L'occupazione di spazio, prodotta dal nodulo, può portare, quando ingravescente, al coinvolgimento delle strutture viciniori della tiroide, provocando alcuni sintomi tipici che permettono di sospettare una patologia tiroidea. Come precedentemente descritto in questo lavoro, l'iperplasia della ghiandola può coinvolgere le strutture nervose ricorrenti (nn. Laringei inferiori), provocando un abbassamento significativo del tono della voce, che può arrivare, nei casi più avanzati, alla paralisi di una o entrambe le corde vocali, con lo sviluppo, nel paziente, di una disfonia permanente. La crescita in senso posteriore, invece, può arrivare a coinvolgere l'asse respiratorio, ovvero la trachea, comprimendo meccanicamente il canale cartilagineo, e causando dispnea e sensazione di ostruzione (il cosiddetto “gnocco in gola”, per come viene riferito dai pazienti) nelle alte vie aeree. Nei casi più avanzati, può esserci compressione dell'esofago, che fa seguito al coinvolgimento tracheale, producendo disfagia e alterazioni nella deglutizione.
Noduli palpabili sono rinvenuti in circa il 5% della popolazione adulta, ma la frequenza varia considerevolmente tra paese e paese. Lo sviluppo dei noduli è più frequente nelle aree gozzigene, a carenza di iodio nell'alimentazione. L'iter diagnostico deve essere in grado di distinguere, da questa percentuale, le lesioni che possono avere carattere di malignità. La maggior parte dei noduli palpabili dal clinico, risulta essere più grande di 1 cm.
Tipicamente, la presenza di tessuto neoplastico nel distretto della ghiandola tiroidea, può accompagnarsi al coinvolgimento latero-cervicale delle stazioni linfonodali peri-giugulari: in questi casi, alla palpazione, sarà possibile evidenziare delle tumefazioni – mobili o ipomobili, di consistenza fibro-elastica o duro-lignea - repertabili nel II-III-IV livello del collo. L'individuazione del coinvolgimento linfonodale depone, già all'esame obiettivo, per un processo neoplastico in corso, da porre in differenziale con altre patologie a carattere linfomatoso o infettivo.
Sulla base delle caratteristiche istologiche della neoplasia (variante papillifera o follicolare), sarà possibile evidenziare o meno un interessamento, nelle forme più avanzate, di organi e tessuti extra-tiroidei: difatti, se l'istotipo papillifero metastatizza per via linfatica e soltanto eccezionalmente per via vascolare, la variante follicolare mostra una maggiore propensione per la metastatizzazione a distanza in altri organi, coinvolgendo meno frequentemente i linfonodi.
Varianti istologiche
Carcinomi differenziati:
- Carcinoma papillifero della tiroide (papillary thyroid carcinoma, PTC) (75% dei tumori tiroidei);
- Carcinoma follicolare della tiroide (follicular thyroid carcinoma, FTC) (15% dei tumori tiroidei):
Altri tumori tiroidei (10%):
- Carcinoma midollare della tiroide
- Carcinoma anaplastico della tiroide
- Linfoma maligno tiroideo
- Carcinoma metastatico della tiroide
Iter diagnostico
L'iter verso la diagnosi di carcinoma differenziato della tiroide comincia, come sopra ricordato, con l' esame obiettivo del collo del paziente. Il corretto iter diagnostico di un nodulo tiroideo è stato codificato nelle più recenti “Linee Guida per la gestione dei pazienti con nodulo tiroideo e carcinoma differenziato della tiroide”, prodotte dalla American Thyroid Association , e ratificate da molte altre società internazionali [16] . La palpazione sarà accompagnata dalla prescrizione dei comuni esami ematologici in grado di verificare la funzionalità della ghiandola tiroidea: TSH , FT 3 , FT 4 . Il primo tra questi permetterà di scegliere la metodica di immagini più appropriata per differenziare il nodulo sospetto in senso di benignità o malignità. Difatti, il rilievo di bassi valori di TSH pone indicazione all'esecuzione di una scintigrafia con radio - iodio , in quanto evidenza di una condizione di iper-tiroidismo da approfondire maggiormente. Questa condizione può essere legata alla presenza di un nodulo solitario iper-funzionante (adenoma tossico di Plummer), generalmente benigno. Il rilievo di un nodulo “freddo” (ipocaptante alla scintigrafia del collo), o di un valore di TSH nella norma o leggermente aumentato, pone indicazione all'esecuzione di un esame ecografico e citologico del nodulo sospetto.
L' ecografia del collo è uno strumento imprescindibile nella diagnosi di CDT. Un'ecografia diagnostica dovrebbe essere eseguita in tutti i pazienti con il sospetto di nodulo tiroideo o gozzo nodulare, o alterazioni radiografiche riscontrante incidentalmente mediante tomografia computerizzata (TC), risonanza magnetica nucleare (RMN), o captazione alla FDG - PET ( Tomografia a emissione di positroni con fluorodesossiglucosio ). La visualizzazione ecografica permette di collegare con certezza l'evidenza palpatoria di una tumefazione del collo alla presenza di un nodulo della ghiandola, confermando il coinvolgimento linfonodale (se presente), identificando le caratteristiche del contenuto del nodulo (liquido, solido o misto), e localizzando correttamente la lesione. Diverse caratteristiche ecografiche quali l'ipoecogenicità del nodulo rispetto al parenchima circostante, la vascolarizzazione intranodulare, i margini irregolari, la presenza di microcalcificazioni, l'assenza di alone periferico e la forma più alta che larga nella scansione trasversale sono stati associati a una più elevata probabilità di malignità [17] [18] .
Con l'eccezione della presenza di linfoadenopatie cervicali sospette, che costituisce una caratteristica altamente specifica ma poco sensibile, le altre caratteristiche ecografiche di sospetto, isolatamente o in combinazione, non costituiscono parametri adeguatamente sensibili e specifici per identificare con certezza tutti i noduli maligni, anche se alcune caratteristiche o associazioni hanno un elevato potere predittivo di malignità [16] . Inoltre, ecograficamente è possibile identificare alcuni elementi che possono distinguere la variante papillifera da quella follicolare: la prima, difatti, si presenta più spesso ipoecogena e solida, spesso con margini irregolari e aumento della vascolarizzazione. La presenza di microcalcificazioni è altamente specifica per PTC, ma queste possono essere difficili da distinguere rispetto alle lacune di colloide . Al contrario, il carcinoma follicolare è più spesso iso-iper ecogeno, con un alone spesso e irregolare, senza microcalcificazioni [19] , e, quando inferiore ai 2 cm, non è mai associato a metastasi [20] . Come ulteriore elemento di valutazione, oltre al color-doppler per identificare i pattern di vascolarizzazione del nodulo, recenti studi hanno dimostrato l'utilità dell'ultra-elasto-sonografia nella diagnosi differenziale dei noduli della tiroide: una tecnica promettente, che richiede ulteriore validazione con studi prospettici [21] .
Contemporaneamente all'esecuzione dell'ecografia, le linee guida ATA prevedono l'esecuzione di un esame citologico con tecnica Fine-Needle-Aspiration . La FNAc eco-guidata è il gold standard nella diagnosi differenziale dei noduli tiroidei, permettendo una accurata identificazione, nella maggior parte dei casi, delle lesioni benigne. L'esame citologico andrebbe eseguito su tutti i noduli con diametro maggiore di 1 cm, venendo sconsigliata nei casi di lesioni sub-centimetriche [16] . Tradizionalmente, i risultati della FNAc sono divisi in 5 categorie: non diagnostico (Tir1), nodulo benigno (Tir2), nodulo dal potenziale indeterminato (Tir3), nodulo con probabile comportamento maligno (Tir4), e nodulo maligno (Tir5) (rischio di malignità alla chirurgia >95%). Per ognuno di questi risultati, oggi le linee guida ATA pongono differente indicazione chirurgica:
| Classificazione AgoAspirato | Significato | Strategia terapeutica |
|---|---|---|
| Tir1 | esame non diagnostico | ripetere agoaspirato |
| Tir2 | nodulo benigno | follow-up |
| Tir3 | nodulo indeterminato | trattamento chirurgico (lobectomia? tiroidectomia radicale?) |
| Tir4 | nodulo con probabile malignità | trattamento chirurgico (tiroidectomia radicale +/- linfectomia) |
| Tir5 | nodulo maligno | trattamento chirurgico (tiroidectomia radicale + linfectomia) |
La categoria “lesione indeterminata”, classificata secondo il Bethesda System come tir3, rappresenta, oggi, uno degli scogli più difficili da superare nella diagnosi di carcinoma tiroideo. Infatti questo riscontro, evidenziabile nel 15-30% degli FNAc [22] , comporta un rischio di malignità del 20-30% [23] : l'impossibilità, alla citologia, di stabilire con certezza le caratteristiche di malignità (problema legato principalmente all'impossibilità a verificare l'invasione e il superamento della capsula), pongono l'indicazione alla chirurgia come strumento di conferma diagnostica. Risulta però evidente che, in circa l'80% di questi pazienti, la tiroidectomia totale rappresenta un intervento sproporzionato rispetto alla diagnosi istologica, necessario però di fronte all'incertezza pre-operatoria. Più recentemente, la Società Italiana di Anatomia Patologica e Citologia Diagnostica – Divisione italiana della International Academy of Pathology (SIAPEC-IAP), ha proposto l'istituzione di due sottocategorie, tir3A e tir3B: nella prima rientrerebbero i casi di iperplasia adenomatoide, e le lesioni non sufficientemente maligne da rientrare nel grado successivo, ma troppo avanzate per essere classificate come benigne. Il grado tir3b verrebbe, invece, assegnato agli adenomi , ai carcinomi follicolari micro invasivi, alle lesioni ossifile a cellule di Hurtle , e infine alle varianti follicolari dei PTC. Inoltre, la SIAPEC-IAP pone indicazione all'intervento chirurgico soltanto nei casi classificati come tir3B, consigliando il follow-up ecografico a sei mesi per le lesioni tir3A [24] .
Diversi markers molecolari, nello specifico la galectina-3 , citocheratina-19 e Hector-Batifora-Mesothelial-1 (HBME-1), sono stati proposti per migliorare l'accuratezza diagnostica dell'agoaspirato [25] . Anche l'uso di marcatori genetici è stato proposto [26] , con particolare successo nel caso dei kit per l'individuazione della mutazione BRAF-V600E (vd. successivamente capitolo “Biologia”). Proprio la ricerca di questa mutazione sembra correlare con una maggiore aggressività, maggior rischio di recidiva post-operatoria, un rischio più alto di invasione vascolare, e una maggiore resistenza alla terapia con radio-iodio. L'esecuzione del test per la mutazione BRAF-V600E potrebbe non essere cost-effective in tutti i pazienti da sottoporre a FNAc, e il suo potenziale per migliorare la selezione dei noduli da portare all'intervento chirurgico potrebbe non essere così elevato. D'altro canto, quando i patologi individuano lesioni citologiche che fanno propendere il sospetto diagnostico verso un PTC, l'esecuzione del test potrebbe portare a maggiori informazioni rispetto al risk-staging del paziente e alla sua prognosi, candidandosi come fattore prognostico in grado di modificare la radicalità dell' intervento chirurgico da proporre [27] . Ancora dibattuto, seppur sempre più al centro del dibattito scientifico, il ruolo dei microRNA all'esame citologico: ai risultati incoraggianti, sarà necessario affiancare un poderoso studio prospettico in grado di identificare l'accuratezza diagnostica di queste metodiche.
Una volta eseguito l'esame citologico, in tutti i casi classificati come tir3b-4-5 vi è indicazione alla chirurgia. Il coinvolgimento linfonodale può essere individuato, con tecniche anatomo-patologiche standard, nel 20-50% dei pazienti con carcinoma differenziato della tiroide (particolarmente nell'istotipo papillifero) [28] , e può essere presente anche quando il tumore è piccolo e intratiroideo [29] . Micrometastasi coinvolgenti le stazioni linfonodali sono evidenziabili in circa il 90% dei casi [30] , ma il loro significato clinico è ancora discusso, risultando controverso il ruolo nel peggiorare la prognosi rispetto alle macrometastasi. L'ecografia del collo individua un coinvolgimento linfonodale nel 20-31% dei casi, influenzando in un 20% [31] dei pazienti l'approccio chirurgico e la relativa radicalità [32] . In ogni caso, a causa dell'effetto-copertura esercitato dalla tiroide, l'ecografia individua soltanto la metà dei linfonodi poi evidenziabili durante la procedura chirurgica [33] .
Esistono delle caratteristiche ecografiche in grado di discriminare tra linfonodi patologici e no: la forma rotondeggiante e non più ovalare, l'aspetto cistico, la vascolarizzazione interna anziché periferica, la perdita dell'ilo, l'ipoecogenicità e le microcalcificazioni. Nessuno di questi parametri, da solo, è abbastanza sensibile da potere essere condizione certa diagnostica di metastasi da carcinoma tiroideo. L'aspetto ecografico con maggiore sensibilità (100%) è la perdita dell'ilo, che però mostra una specificità del 29% [34] . Le stazioni linfonodali coinvolte possono aiutare a porre il sospetto, risultando i livelli III-IV-VI maggiormente interessati dalla malattia rispetto al II livello. Una conferma della malignità è possibile ottenerla attraverso esame FNAc con dosaggio della tireoglobulina nel liquido di lavaggio. Quest'ultimo è affidabile anche in pazienti con anticorpi anti-Tg circolanti [35] .
Uno staging accurato è conditio sine qua non per determinare la prognosi e per individualizzare il trattamento dei pazienti con tumore differenziato della tiroide. La presenza di tessuto metastatico non solleva dalla necessità di procedere alla rimozione chirurgica del tumore primitivo. Infatti, poiché le metastasi possono rispondere al trattamento con radio-iodio, la rimozione del tumore e del tessuto tumorale loco-regionale rimane una componente importante del trattamento iniziale [16] .
Indicazioni alla chirurgia
L'obiettivo della terapia chirurgica consiste nella rimozione del tumore primitivo, il tessuto tumorale esteso oltre la capsula tiroidea ei linfonodi cervicali coinvolti. La completezza della resezione chirurgica costituisce un importante fattore capace di influenzare il risultato finale, mentre eventuali linfonodi metastatici residui rappresentano il più comune sito di persistenza/ripresa di malattia. Altri obiettivi, individuati sempre dalle linee guida internazionali stilate dall'ATA, prevedono l'accurata stadiazione post-operatoria attraverso l'esame istologico della ghiandola asportata; e la facilitazione del trattamento post-operatorio con iodio radioattivo, per il quale la rimozione di tutto il tessuto tiroideo normale costituisce requisito fondamentale.
Nei casi di citologia non diagnostica o indeterminata, ai pazienti con una neoplasia inferiore ai 4 cm, che lo vogliano, può essere proposto un intervento meno radicale, consistente nella lobectomia tiroidea. Questo intervento, che permette comunque di stadiare e inquadrare istologicamente la neoplasia, si caratterizza per una minore radicalità, giustificata dall'alto tasso di pazienti privi di lesione maligna (circa l'80%). Ma in un 20% circa dei casi, costringe il paziente a sottoporsi a un secondo intervento di totalizzazione, indicato dallo studio istologico del lobo asportato, qualora il risultato confermasse il sospetto di malignità [36] .
Di fronte a una biopsia diagnostica per nodulo maligno, si pone indicazione all'esecuzione di una tiroidectomia totale, in tutti i casi in cui la massa sia maggiore di 1 cm. Ulteriori evidenze, più recenti, hanno dimostrato l'utilità di un approccio maggiormente radicale anche nei confronti delle masse minori di 1 cm (cosiddetti microcarcinomi): uno studio con oltre 50.000 pazienti con PTC ha mostrato all'analisi multivariata che la tiroidectomia totale migliora significativamente i tassi di sopravvivenza e recidiva in pazienti con tumore <1 cm [37] . Anche l'età avanzata (>45 anni) può essere un'indicazione al trattamento chirurgico totale o quasi-totale anche per tumori <1-1,5 cm a causa degli alti tassi di recidiva di malattia in questa fascia di età [38] [39] [40] [41] .
Le metastasi linfonodali, alla diagnosi, sono presenti nel 20-90% dei pazienti con PTC, e proporzionalmente in misura minore negli altri istotipi [42] [43] . Anche se le metastasi linfonodali da PTC hanno dimostrato di avere, secondo alcuni, un importante effetto sull'esito di pazienti a basso rischio, uno studio del database della Surveillance, Epidemiology, and END research (SEER) ha mostrato che su 9 904 pazienti con PTC, la presenza di metastasi linfonodali, l'età >45anni, metastasi a distanza e aumentate dimensioni tumorali erano predittori significativi di prognosi poco favorevole all'analisi multivariata [44] . La sopravvivenza assoluta a 14 anni era dell'82% per PTC senza metastasi linfonodali, e del 79% con metastasi linfonodali ( p < 0,05).
In definitiva, il ruolo della linfoadenectomia non trova ancora sufficiente accordo tra gli esperti. Difatti, già nelle linee guida ATA, si consiglia di eseguire una tiroidectomia totale con linfoadenectomia centrale soltanto se si repertano linfonodi patologici, nel caso in cui l'operatore che esegue la procedura non sia sufficientemente esperto. Allo stato attuale, si pone indicazione all'intervento di linfoadenectomia centrale terapeutica (VI livello), contemporaneamente all'intervento di tiroidectomia totale, quando è presente un coinvolgimento clinico dei linfonodi del compartimento centrale o laterocervicali, assicurando una completa liberazione da malattia nella regione centrale del collo. Invece, per la linfoadenectomia profilattica , si lascia libertà di giudizio all'operatore, consigliandola nei casi di malattia avanzata (T3 o T4).
Terapia radiometabolica
Questa terapia è spesso utilizzata nel trattamento dei tumori tiroidei differenziati (cioè in grado di accumulare il radioiodio ), successivamente all'intervento chirurgico, per distruggere il tessuto tiroideo residuo, la malattia residua eventualmente presente nel letto operatorio e le metastasi a distanza (che possono anche essere rilevate mediante scintigrafia ).
Si esegue somministrando al paziente, in regime di ricovero protetto all'interno di un reparto di medicina nucleare , il radioiodio stesso (per la precisione, l'isotopo 131 dello iodio ). Questa sostanza, comportandosi esattamente come lo iodio stabile normalmente assunto con la dieta dal paziente, si accumula solo nel tessuto tiroideo residuo e nelle eventuali metastasi linfonodali ea distanza, permettendone la distruzione selettiva mediante il rilascio in loco di un'alta dose di radiazioni . Non è mai stato dimostrato un aumento di incidenza di secondi tumori nei pazienti trattati. Controindicazioni assolute sono la gravidanza in atto e l' allattamento (se non interrotto definitivamente). La quantità di iodio somministrata al paziente col trattamento è molto bassa e quindi non sufficiente a scatenare reazioni in soggetti allergici allo iodio; l'allergia allo iodio pertanto non è una controindicazione.
Fattori prognostici e sistemi di risk staging
La prognosi dei tumori papilliferi della tiroide è condizionata da differenti fattori, composti da elementi clinici, patologici e molecolari. Nonostante una prognosi generalmente molto favorevole, i PTC – che ricordiamo essere la più frequente neoplasia maligna endocrinologica negli umani – possono essere suddivisi in due gruppi: una grossa maggioranza di pazienti che va incontro a remissione completa, e una percentuale più piccola che va incontro a un decorso clinico maggiormente aggressivo, se non anche all'exitus. Questa constatazione si associa all'evidenza che, nel 10-15% dei PTC [45] , si assiste a una trasformazione – per lo più ancora inspiegata - di queste neoplasie, che da responsive alla terapia divengono radio-iodio-resistenti, e possono causare la morte del paziente. In generale, comunque, nei pazienti affetti da PTC ben differenziato (DTC), si è evidenziato un tasso di sopravvivenza a dieci anni superiore all'85% nella maggior parte delle casistiche [46] [47] [48] .
Moltissimi fattori sono stati studiati per cercare di determinare la prognosi, e più nello specifico il rischio di recidiva, di questa patologia. Alcuni di questi possono essere studiati pre-operativamente, permettendo di dare un'indicazione alla tipologia di intervento a cui candidare il paziente, mentre altri sono calcolabili solamente dopo l'intervento chirurgico, e sono utili per programmare il follow-up. Un elemento di difficoltà in proposito è rappresentato dalla necessità di un periodo di osservazione lungo, dell'ordine dei 15-20 anni, per poter rilevare differenze prognostiche e per escludere definitivamente la possibilità di recidiva.
Lo staging della neoplasia è considerato essere, sicuramente, uno dei fattori prognostici più importanti, esattamente come negli altri modelli di cancro umano. La classificazione proposta dalla UICC/AJCC attualmente è quella che riscuote maggiore successo ai fini stadiativi, basandosi sul sistema internazionale TNM. Questa classificazione, inoltre, ha dimostrato di riuscire a prevedere il rischio di morte dei pazienti affetti da carcinoma differenziato, ma non il rischio di recidiva [16] .
L'età alla diagnosi si conferma, negli studi più recenti [45] , un importante elemento di valutazione: infatti, l'effetto avverso dell'età nella prognosi aumenta gradualmente ogni dieci anni di vita, soprattutto dopo i 40-45 anni [40] . Da un punto di vista pratico, i pazienti con diagnosi prima dei 45 anni hanno una prognosi migliore rispetto a quelli più anziani. Questo cut-off fissato a 45 anni è uno dei parametri più importanti utilizzati nella stadiazione proposta dalla UICC/AJCC staging system. Questa relazione è stata osservata grazie a studi condotti su bambini, i quali hanno mostrato un tasso di mortalità più basso, anche se nelle età più giovani è più frequente la presentazione della malattia sotto forma di neoplasia estesa e metastatica [49] . I pazienti più anziani sono affetti da una maggiore incidenza di varianti istologiche aggressive, malattia estesa e metastasi a distanza alla diagnosi. I tumori tendono a essere meno differenziati nell'anziano, con un uptake dello iodio-131 minore se comparati con soggetti giovani [50] , e nel primo si assiste a una maggiore e più rapida incidenza di ricorrenza di malattia dopo il trattamento iniziale. Almeno 5 classificazioni (EORTEC, TNM, AGES, AMES e MACIS), sviluppate attorno agli anni ottanta, hanno avuto una notevole diffusione, ma almeno altrettante sono state proposte da singoli gruppi di ricerca (MSK, Ohio, ecc.). Premettiamo da subito che tutte queste classificazioni, per quanto ancora possano essere oggetto di dibattito in letteratura, trovano sempre meno applicazione nella pratica clinica, sostituite dalle classificazioni proposte dall'American Thyroid Association (ATA), dalla European Thyroid Association (ETA) e dalla Latin American Thyroid Society (LATS), ma soprattutto dalla stadiazione AJCC basata sulla classificazione TNM .
Sopravvivenza generale a 5 e 10 anni in base alla variante istologica di tumore della tiroide [51] [52] [53] [54] [55] [56]
Tipo di tumore delle tiroide | Sopravvivenza a 5 anni | Sopravvivenza a 10 anni | ||||
|---|---|---|---|---|---|---|
| Stadio I | Stadio II | Stadio III | Stadio IV | Complessivamente | Complessivamente | |
| Papillare | 100% | 100% | 93% | 51% | 96%-97% | 93% |
| Follicolari | 100%< | 100%< | 71% | 50% | 91% | 85% |
| Midollare | 100%< | 98% | 81% | 28% | 80%, 83% o 86% | 75% |
| Anaplastico | (spesso stadio IV) | 7% | 7%-14% | (nessun dato) | ||
Biologia molecolare
Le alterazioni genetiche, alla base delle mutazioni in senso oncogenetico, delle neoplasie maligne delle cellule follicolari della tiroide sono concentrate attorno a due vie molecolari: la via della protein chinasi mitogeno attivata (MAP) e la via della fosfatidil-inositolo-3-chinasi (PI-3K)/AKT. Nella loro normale attivazione, queste vie sono utilizzate temporaneamente attraverso il legame tra il fattore di crescita e le tirosin-chinasi recettoriali (mediato attraverso il dominio extracellulare), che comporta l'autofosforilazione del dominio citoplasmatico, consentendo la traduzione del messaggio. Nei carcinomi della tiroide, così come in altri tumori solidi, le mutazioni che comportano un' acquisizione di funzione , lungo le componenti di queste vie, portano a un'attivazione costitutiva anche in assenza di ligando, promuovendo in tal modo la cancerogenesi [57] . Nei carcinomi papillari, l'attivazione della via delle MAP-chinasi è pressoché costante, e avviene in seguito a due meccanismi di seguito descritti. Il primo comporta riarrangiamenti di RET o NTRK1 (Neurotrophic Tyrosine Kinase Receptor 1), entrambi codificanti per tirosin-chinasi transmembrana. Il secondo meccanismo implica invece mutazioni puntiformi del gene BRAF, il cui prodotto è una componente intermedia della via delle MAP-chinasi. La trasformazione neoplastica, inoltre e più in generale, può dipendere da vari meccanismi genetici ed epigenetici che includono: attivazione e inattivazione di mutazioni somatiche, alterazioni nei pattern di espressione genica, disregolazione dei microRNA e metilazione aberrante dei geni [58] .
Il gene RET si trova sul cromosoma 10q11, e la proteina derivante dalla codificazione del gene non è normalmente espressa dalle cellule epiteliali della tiroide, bensì dalle cellule parafollicolari C. A causa di fenomeni non ancora completamente compresi, nell'oncogenesi dei PTC è possibile rinvenire inversioni paracentriche del cromosoma 10 o una traslocazione reciproca tra i cromosomi 10 e 17: queste alterazioni cromosomiche mettono sotto il controllo trascrizionale dei geni costitutivamente espressi dalle cellule epiteliali della tiroide le tirosin-chinasi espresse dal gene RET. I geni di fusione, chiamati RET/PTC sono presenti in circa il 20-40% dei carcinomi papilliferi della tiroide. Vi sono oltre 15 partner di fusione di RET, due in particolare – RET/PTC1 e RET/PTC2 – sono osservabili comunemente nelle forme sporadiche. La frequenza di questi riarrangiamenti è più alta nei pazienti esposti a radiazioni. La proteina RET/PTC è una classica oncoproteina che attiva le vie MAPK e PI3K-AKT [59] . Essa è in grado di attivarle entrambe, reclutando adattatori di segnale e legandoli per fosforilazione al dominio intracellulare della proteina di fusione.
Allo stesso modo, inversioni paracentriche o traslocazioni di NTRK1 sul cromosoma 1q21 sono presenti nel 5-10% dei PTC. Le proteine derivate sono espresse costitutivamente dai tireociti, e portano all'attivazione della via delle MAP-chinasi e di altre vie di regolazione.
In circa il 45% dei carcinomi papilliferi della tiroide [60] si presenta una mutazione puntiforme con acquisizione di funzione del gene BRAF, specificamente una variazione valina-glutammato sul codone 600 (BRAFV600E), che porta alla mutazione di queste serina/treonina chinasi.
Poiché le mutazioni dei geni RET, NTRK1 e BRAF hanno effettori simili sul tessuto tiroideo (tutte quante portano all'attivazione costitutiva della via delle MAP-chinasi), nei carcinomi papilliferi non è possibile individuare entrambe le mutazioni contemporaneamente: i PTC mostrano, infatti, o l'una o l'altra mutazione molecolare. Infine, queste mutazioni non sono rinvenibili nell'istotipo follicolare o nell'adenoma tiroideo.
Nella variante follicolare del PTC, l'analisi mutazionale dei geni mostra una differente storia oncologica: difatti, si notano una minore frequenza dei riarrangiamenti RET/PTC e una frequenza maggiormente aumentata di mutazioni RAS. Inoltre, spesso la mutazione BRAF è distinta rispetto a quella convenzionale, caratterizzandosi per una ridotta attivazione della proteina BRAF-K [57] .
La variante a cellule alte presentano mutazioni BRAF in quasi tutti i casi (55-100%) e mostrano spesso traslocazioni di RET/PTC. La presenza, non convenzionale, di entrambe le mutazioni, può correlare con la peggiore prognosi di queste neoplasie. La variante sclerosante diffusa non presenta mai mutazioni di BRAF, ma prevalentemente (nella metà dei casi) traslocazioni di RET/PTC.
Mutazioni genetiche
La mutazione BRAFV600E è stata associata quasi dieci anni fa, attraverso uno studio multicentrico, a una maggiore aggressività clinico-patologica, con un maggiore tasso di recidiva, di resistenza alla terapia con radioiodio , fallimento terapeutico, e in generale una maggiore aggressività [61] .
A destare l'attenzione e l'interesse per questa mutazione, è stata la recente scoperta, in alcuni PTC umani, di un'eterogeneità intra-tumorale nel genotipo di BRAF: in una minoranza di casi si è rinvenuta la mutazione BRAFV600E, e in una maggioranza il BRAF-wilde typ [62] . Questo ha dato vita a un dibattito, ancora acceso, su cosa venga prima (“ chicken and eggs puzzle ”): se la mutazione del BRAF dia l'avvio alla tumorigenesi, o se invece segua l'evoluzione verso la malignità. Da ciò, comunque, si possono trarre due conclusioni: che la mutazione del BRAF sia un evento genetico secondario nella tumorigenesi [63] ; oppure che una volta che la mutazione del BRAF ha attivato la trasformazione neoplastica in PTC, ulteriori alterazioni oncogeniche possono subentrare, guidando la tumorigenesi e scalzando il ruolo di BRAF [64] . L'evidenza che la mutazione è presente nel 20-40% dei carcinomi scarsamente differenziati, e nel 30-40% degli anaplastici, fa ritenere che la proteina di fusione giochi un ruolo importante nella de-differenziazione dei tireociti e quindi, più in generale, per una maggiore aggressività della neoplasia [65] [66] [67] .
Seconda per prevalenza, dopo BRAF, è la mutazione di RAS. Questa proteina è costituzionalmente espressa dai tireociti , e si attiva attraverso il legame con il GTP. La GTPasi intrinseca di questa proteina , attraverso l' idrolisi dei legami, scinde la GTP dai recettori di RAS, defosforilandoli, e portando RAS in uno stato inattivato, ponendo fine alla trasmissione del segnale . Mutazioni in questa proteina possono comportare la deattivazione della GTPasi, lasciando RAS in uno stato di perenne attivazione. Ci sono 3 isoforme di RAS: HRAS, KRAS e NRAS. Quest'ultima è quella che si associa, più frequentemente, ai tumori della tiroide. Inoltre, RAS è una proteina fondamentale per l'attivazione della via delle MAPK e PI3K-AKT. Queste mutazioni occorrono frequentemente negli adenomi follicolari della tiroide, una lesione presumibilmente pre-maligna, fatto che sta facendo supporre che RAS-attivato abbia un ruolo nella tumorigenesi dei tumori follicolari della tiroide, anche se la sua sola mutazione non è sufficiente per generare la trasformazione nell'istotipo carcinomatoso [68] . Delezioni di PTEN (un gene oncosoppressore) sono le tipiche alterazioni genetiche che portano a un'attivazione della via PI3K-AKT, e sono la base genetica per la tumorigenesi delle cellule follicolari tiroidee nella sindrome di Cowden.
Infine, altri importanti geni mutati includono la beta-catenina (CTNNB1), TP53, isocitrato-deidrogenasi-1 , chinasi del linfoma anaplastico (ALK), e il recettore del fattore di crescita dell'epidermide (EGFR). La maggiore frequenza di queste mutazioni nelle forme anaplastiche di tumore della tiroide, fa supporre che esse potrebbero avere un ruolo nella progressione verso l'aggressività.
Oncogenesi e progressione: un modello biomolecolare
Dagli studi traslazionali e molecolari più recenti, emerge con decisione il ruolo principale delle vie metaboliche delle MAPKinasi e della via PI3K-ATK. L'analisi genetica della neoplasia nelle sue varie forme evolutive, sembra dimostrare come l'attivazione preferenziale, attraverso specifiche alterazioni, di una delle due vie, indirizza lo sviluppo neoplastico in senso papillare (MAPK), o in senso adenomatoso (FTA) e follicolare (FTC). Quando le alterazioni si accumulano, ed entrambe le vie vengono attivate, si assiste a una progressione in senso de-differenziativo, verso le forme scarsamente differenziate (PDTC) e anaplastiche (ATC). Questa evoluzione può essere accelerata o mediata anche da altri eventi genetici, includenti mutazioni in TP53, CTNNB1 e ALK.
Questo modello è supportato da studi su topi transgenici , nei quali la delezione di Pten e il knock-in di Kras G12D (atto ad attivare entrambe le vie metaboliche sopra citate), causa lo sviluppo di una forma aggressiva di cancro della tiroide [69] .
Riarrangiamenti di RET/PTC sono individuati sino all'80% dei PTC in individui esposti a radiazioni ionizzanti accidentali o terapeutiche. L'esposizione alle radiazioni di Černobyl' ha particolarmente aumentato la frequenza della mutazione RET/PTC3 [70] . È vero l'opposto, invece, nel caso delle mutazioni puntiformi di BRAF e di RAS, le quali sono rare nei tumori correlati all'esposizione alle radiazioni, ma comuni nella popolazione generale [71] .
Note
- ^ Briseis A. Kilfoy et al. , International Patterns and Trends in Thyroid Cancer Incidence, 1973–2002 , in Cancer Causes & Control , vol. 20, n. 5, Springer, luglio 2009, pp. 525-531. Accesso condizionato via Jstor
- ^ Bryan R. Haugen, Erik K. Alexander e Keith C. Bible, 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer , in Thyroid: Official Journal of the American Thyroid Association , vol. 26, n. 1, 2016-01, pp. 1–133, DOI : 10.1089/thy.2015.0020 . URL consultato il 9 agosto 2021 .
- ^ SEER Stat Fact Sheets: Thyroid Cancer , su NCI . URL consultato il 18 giugno 2014 .
- ^ Margherita Dionisi-Vici, Marta Fantoni e Rossana Botto, Distress, anxiety, depression and unmet needs in thyroid cancer survivors: a longitudinal study , in Endocrine , 18 giugno 2021, DOI : 10.1007/s12020-021-02786-y . URL consultato il 4 agosto 2021 .
- ^ a b c d e f g h Anastasi
- ^ a b c d e f g h Testut
- ^ Paletto
- ^ DeAntoni , pp.209-216 .
- ^ AJCC, American Join Committee on Cancer et al. , Cancer staging manual , 7ª ed., NewYork, Springer, 2010, ISBN 978-0-387-88440-0 (archiviato dall' url originale il 30 settembre 2015) .
- ^ a b AIOM, I numeri del cancro ( PDF ).
- ^ MP Curado et al. , Cancer incidence in Five continents , IARC Scientific Publications, 2014, ISBN 978-92-832-2165-4 .
- ^ A. Jemal et al. , Cancer statistics, 2010 , in CA: a cancer journal for clinicians , vol. 60, n. 5, settembre-ottobre 2010, pp. 277-300.
- ^ L. Dal Maso et al. , Incidence of thyroid cancer in Italy, 1991-2005: time trends and age-period-cohort effects. , in Ann Oncol , vol. 22, n. 4, Apr 2011, pp. 957-63, DOI : 10.1093/annonc/mdq467 , PMID 20952599 .
- ^ B. Aschebrook-Kilfoy et al. , The acceleration in papillary thyroid cancer incidence rates is similar among racial and ethnic groups in the United States. , in Ann Surg Oncol , vol. 20, n. 8, agosto 2013, pp. 2746-53, DOI : 10.1245/s10434-013-2892-y , PMID 23504142 .
- ^ L. Enewold et al. , Rising thyroid cancer incidence in the United States by demographic and tumor characteristics, 1980-2005. , in Cancer Epidemiol Biomarkers Prev , vol. 18, n. 3, marzo 2009, pp. 784-91, DOI : 10.1158/1055-9965.EPI-08-0960 , PMID 19240234 .
- ^ a b c d e Cooper DS et al. , Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer , in Thyroid , vol. 19, n. 11, 2009, pp. 1167–214, DOI : 10.1089/thy.2009.0110 , PMID 19860577 .
- ^ Baloch ZW et al. , Diagnostic terminology and morphologic criteria for cytologic diagnosis of thyroid lesions: a synopsis of the National Cancer Institute Thyroid Fine-Needle Aspiration State of the Science Conference , in Diagn. Cytopathol. , vol. 36, n. 6, 2008, pp. 425–37, DOI : 10.1002/dc.20830 , PMID 18478609 .
- ^ Cappelli C et al. , The predictive value of ultrasound findings in the management of thyroid nodules , in QJM , vol. 100, n. 1, 2007, pp. 29–35, DOI : 10.1093/qjmed/hcl121 , PMID 17178736 .
- ^ Moon WJ et al. , Benign and malignant thyroid nodules: US differentiation--multicenter retrospective study [ collegamento interrotto ] , in Radiology , vol. 247, n. 3, 2008, pp. 762–70, DOI : 10.1148/radiol.2473070944 , PMID 18403624 .
- ^ Jeh SK et al. , Evaluating the degree of conformity of papillary carcinoma and follicular carcinoma to the reported ultrasonographic findings of malignant thyroid tumor , in Korean J Radiol , vol. 8, n. 3, 2007, pp. 192–7, PMC 2627417 , PMID 17554185 .
- ^ Rago T et al. , Elastography: new developments in ultrasound for predicting malignancy in thyroid nodules [ collegamento interrotto ] , in J. Clin. Endocrinol. Metab. , vol. 92, n. 8, 2007, pp. 2917–22, DOI : 10.1210/jc.2007-0641 , PMID 17535993 .
- ^ Hegedüs L, Clinical practice. The thyroid nodule , in N. Engl. J. Med. , vol. 351, n. 17, 2004, pp. 1764–71, DOI : 10.1056/NEJMcp031436 , PMID 15496625 .
- ^ C. Carmeci et al. , Ultrasound-guided fine-needle aspiration biopsy of thyroid masses. , in Thyroid , vol. 8, n. 4, Apr 1998, pp. 283-9, PMID 9588492 .
- ^ M. Bongiovanni et al. , The Bethesda System for Reporting Thyroid Cytopathology: a meta-analysis , in Acta Cytol , vol. 56, n. 4, 2012, pp. 333-9, DOI : 10.1159/000339959 , PMID 22846422 .
- ^ Armando Bartolazzi et al. , Galectin-3-expression analysis in the surgical selection of follicular thyroid nodules with indeterminate fine-needle aspiration cytology: a prospective multicentre study , in Lancet Oncol. , vol. 9, n. 6, 2008, pp. 543–9, DOI : 10.1016/S1470-2045(08)70132-3 , PMID 18495537 .
- ^ Sapio MR et al. , Detection of RET/PTC, TRK and BRAF mutations in preoperative diagnosis of thyroid nodules with indeterminate cytological findings , in Clin. Endocrinol. (Oxf) , vol. 66, n. 5, 2007, pp. 678–83, DOI : 10.1111/j.1365-2265.2007.02800.x , PMID 17381488 .
- ^ M. Mekel, C. Nucera, R. Hodin e S. Parangi, «Surgical implication of brafv600e mutation in fine-needle aspiration of thyroid nodules,» Am J Surg, vol. 200, n. 1, 2010.
- ^ E. Papini, R. Guglielmi, A. Bianchini, A. Crescenzi, S. Taccogna, F. Nardi, C. Panunzi, R. Rinaldi, V. Toscano e C. Pacella, «Risk of malignancy in nonpalpable thyroid nodules: predictive value of ultrasound and color-doppler features,» J Clin Endocrinol Metab, vol. 87, pp. 1941-1946, 2002.
- ^ S. Chow, S. Law, J. Chan, S. Au, S. Yau e W. Lau, «Papillary microcarcinoma of the thyroid-Prognostic significance of lymph node metastasis and multifocality.,» Cancer, vol. 98, pp. 31-40, 2003.
- ^ S. Qubain, S. Nakano, M. Baba, S. Takao e T. Aikou, «Distribution of lymph node micrometastasis in pN0 welldifferentiated thyroid carcinoma.,» Surgery, vol. 131, pp. 249-256, 2002.
- ^ J. Stulak, C. Grant, D. Farley, G. Thompson, J. van Heerden, I. Hay, C. Reading e J. CHarboneau, «Value of preoperative ultrasonography in the surgical management of initial and reoperative papillary thyroid cancer,» Arch Surg, vol. 141, pp. 489-494, 2006.
- ^ C. Solorzano, D. Carneiro, M. Ramirez, T. Lee e G. Irvin, «Surgeon-performed ultrasound in the management of thyroid malignancy,» Am Surg, vol. 70, pp. 576-580, 2004.
- ^ S. Leboulleux, E. Girad, M. Rose, J. Travagli, N. Sabbah, B. Caillou, D. Hartl, N. Lassau, E. Baudin e M. Schlumberger, «Ultrasound criteria of malignancy for cervical lymphnodes in patients followed up for differentiated thyroid cancer,» J Clin Endocrinol Metab, vol. 92, pp. 3590-3594, 2007.
- ^ S. Kuna, I. Bracic, V. Tesic, K. Kuna, G. Herceg e D. Dodig, «Ultrasonographic differentiation of benign from malignant neck lymphadenopathy in thyroid cancer,» J Ultrasound Med, vol. 25, pp. 1531-1537, 2006.
- ^ F. Boi, G. Baghino, F. Atzeni, M. Lai, G. Faa e S. Mariotti, «THe diagnostic value for differentiated thyroid carcinoma metastases of thyroglobulin measurement in washout fluid from fine needle aspiration biopsy of neck lymph nodes is maintained in the presence of circulating anti-Tg antibodies,» J Clin Endocrinol Metab, p. 91, 1364-1369.
- ^ H. Gharib, J. Goellner, A. Zinsmeister, C. Grant e J. Van Heerden, «Fine-needle aspiration biopsy of the thyroid. The problem of suspicious cytologic findings,» Ann Intern Med, vol. 101, pp. 25-28, 1984
- ^ K. Bilimora, D. Bentrem, C. Ko, A. Stewart, D. Winchester, M. Talamonti e C. Sturgeon, «Extent of surgery affects survival for papillary thyroid cancer,» Ann Surg, vol. 246, pp. 375-381, 2007.
- ^ J. van Heerden, I. Hay, J. Goellner, D. Salomao, J. Ebersold, E. Bergstralh e C. Grant, «Follicular thyroid carcinoma with capsular invasion alone: a nonthreatening malignancy,» Surgery, vol. 112, pp. 1130-1136, 1992.
- ^ I. Hay et al. , Predicting outcome in papillary thyroid carcinoma: development of a realiable progonostic scoring system in a cohort of 1779 patients surgically treat at our institution during 1940 throught 1989 , in Surgery , vol. 114, n. 6, dicembre 1993, PMID 8256208 .
- ^ a b ID. Hay et al. , Papillary thyroid carcinoma managed at the Mayo Clinic during six decades (1940-1999): temporal trends in initial therapy and long-term outcome in 2444 consecutively treated patients. , in World J Surg , vol. 26, n. 8, Aug 2002, pp. 879-85, DOI : 10.1007/s00268-002-6612-1 , PMID 12016468 .
- ^ J. Lin, T. Chao, M. Huang, H. Weng e K. Tzen, «Use of radioactive iodine for thyroid remnant ablation in welldifferentiated thyroid carcinoma to replace thyroid reoperation,» Am J Clin Oncol, vol. 21, pp. 77-81, 1998.
- ^ S. Grebe e I. Hay, «Thyroid cancer nodal metastases: biologic significance and therapeutic considerations,» Surg Oncol Clin N AM, vol. 5, pp. 43-63, 1996.
- ^ M. Kouvaraki, S. Shapiro, B. Fornage, B. Edeiken-Monro, S. Sherman, R. Vassilopoulou-Sellin, J. Lee e D. Evans, «Role of preoperative ultrasonography in the surgical management of patients with thyroid cancer,» Surgery, vol. 134, pp. 946-954, 2003
- ^ Y. Podnos, D. Smith, L. Wagman e J. Ellenhorn, «The implication of lymph node metastasis on survival in patients with well-differentiated thyroid cancer,» Am Surg, vol. 71, pp. 731-734, 2005.
- ^ a b P. Soares, R. Celestino, M. Melo, E. Fonseca e M. Sobrinho-Simoes, «Prognostic biomarkers in thyroid cancer,» Virchows Archive, 2013.
- ^ S. Hundahl, I. Fleming, A. Fremgen e H. Menck, «A national cancer data base report on 53,856 cases of thyroid carcinoma treated in the US, 1985-1995,» Cancer, vol. 12, n. 83, pp. 2638-2648, 1998.
- ^ F. Gilliland, W. Hunt, D. Morris e C. Key, «Prognostic factors for thyroid carcinoma. A population-based study of 15,698 cases from the Surveillance, Epidemiology and End Results (SEER) program 1973-1991,» Cancer, vol. 3, n. 79, pp. 564-573, 1997.
- ^ R. Elisei, E. Molinaro, L. Agate, V. Bottici, L. Masserini, C. Ceccarelli, F. Lippi, L. Grasso, F. Basolo, G. Bevilacqua, P. Miccoli, G. Di Coscio, P. Vitti, F. Pacini e A. Pinchera, «Are the clinical and pathological features of differentiated thyroid carcinoma really changed over the last 35 years? Study on 4187 patients from a single italian institution to answer this question,» J Clin Endocrinol Metab, vol. 4, n. 95, pp. 1516-1527, 2010.
- ^ S. Leboullex, D. Hartl, F. Baudin e M. Schlumberger, «Differentiated thyroid cancer in childhood,» Bull du Cancer, pp. 1093-1099, 2012.
- ^ M. Schlumberger, C. Challeton, F. De Vathaire, J. Travagli, P. Gardet, J. Lumbroso, C. Francese, F. Fontaine, M. Ricard e C. Parmentier, «Radioactive iodine treatment and external radiotherapy for lung and bone metastases from thyroid carcinoma,» J Nuclear Medicine, vol. 4, n. 37, pp. 598-605, 1996
- ^ Thyroid Cancer Survival Rates , in AJCC Cancer Staging Manual , 7ª ed., The American Cancer Society..
- ^ Thyroid cancer , su books.google.se , p. 10.
- ^ F. Grünwald et al. , Thyroid cancer , Berlin, Springer, 2005, ISBN 3-540-22309-6 .
- ^ Luigi Santacroce, Silvia Gagliardi e Andrew Scott Kennedy, Papillary Carcinoma , su emedicine.medscape.com , settembre 2010.
- ^ Barbet J et al. , Prognostic Impact of Serum Calcitonin and Carcinoembryonic Antigen Doubling-Times in Patients with Medullary Thyroid Carcinoma , in Journal of Clinical Endocrinology & Metabolism , vol. 90, n. 11, 2005, pp. 6077–6084, DOI : 10.1210/jc.2005-0044 , PMID 16091497 .
- ^ Medullary Thyroid Cancer , su cancer.gov , National Cancer Institute, dicembre 2010.
- ^ a b Robbins .
- ^ ( EN ) YE Nifikorov e MN Nifikorova, Molecular genetics and diagnosis of thyroid cancer , in Nature Rev. Endocrinol. , n. 7, 2011, pp. 569-580.
- ^ ( EN ) M. Castellone et al. , The beta-catenin axis integrates multiple signals downstream from RET/papillary thyroid carcinoma leading to cell proliferation , in Cancer Res. , n. 69, 2009, pp. 1867-1876.
- ^ ( EN ) M. Xing, BRAF mutation in Thyroid cancer , in Endocr Relat Cancer , n. 12, 2005, pp. 245-262.
- ^ Xing M et al. , BRAF mutation predicts a poorer clinical prognosis for papillary thyroid cancer [ collegamento interrotto ] , in J. Clin. Endocrinol. Metab. , vol. 90, n. 12, 2005, pp. 6373–9, DOI : 10.1210/jc.2005-0987 , PMID 16174717 .
- ^ Guerra A et al. , The primary occurrence of BRAF(V600E) is a rare clonal event in papillary thyroid carcinoma [ collegamento interrotto ] , in J. Clin. Endocrinol. Metab. , vol. 97, n. 2, 2012, pp. 517–24, DOI : 10.1210/jc.2011-0618 , PMID 22170714 .
- ^ Vasko V et al. , High prevalence and possible de novo formation of BRAF mutation in metastasized papillary thyroid cancer in lymph nodes [ collegamento interrotto ] , in J. Clin. Endocrinol. Metab. , vol. 90, n. 9, 2005, pp. 5265–9, DOI : 10.1210/jc.2004-2353 , PMID 15998781 .
- ^ Xing M, BRAFV600E mutation and papillary thyroid cancer: chicken or egg? [ collegamento interrotto ] , in J. Clin. Endocrinol. Metab. , vol. 97, n. 7, 2012, pp. 2295–8, DOI : 10.1210/jc.2012-2201 , PMC 3387401 , PMID 22774213 .
- ^ Namba H et al. , Clinical implication of hot spot BRAF mutation, V599E, in papillary thyroid cancers [ collegamento interrotto ] , in J. Clin. Endocrinol. Metab. , vol. 88, n. 9, 2003, pp. 4393–7, DOI : 10.1210/jc.2003-030305 , PMID 12970315 .
- ^ Nikiforova MN et al. , BRAF mutations in thyroid tumors are restricted to papillary carcinomas and anaplastic or poorly differentiated carcinomas arising from papillary carcinomas [ collegamento interrotto ] , in J. Clin. Endocrinol. Metab. , vol. 88, n. 11, 2003, pp. 5399–404, DOI : 10.1210/jc.2003-030838 , PMID 14602780 .
- ^ Ricarte-Filho JC et al. , Mutational profile of advanced primary and metastatic radioactive iodine-refractory thyroid cancers reveals distinct pathogenetic roles for BRAF, PIK3CA, and AKT1 [ collegamento interrotto ] , in Cancer Res. , vol. 69, n. 11, 2009, pp. 4885–93, DOI : 10.1158/0008-5472.CAN-09-0727 , PMC 2690720 , PMID 19487299 .
- ^ Xing M, Molecular pathogenesis and mechanisms of thyroid cancer , in Nat. Rev. Cancer , vol. 13, n. 3, 2013, pp. 184–99, DOI : 10.1038/nrc3431 , PMC 3791171 , PMID 23429735 .
- ^ Miller KA et al. , Oncogenic Kras requires simultaneous PI3K signaling to induce ERK activation and transform thyroid epithelial cells in vivo , in Cancer Res. , vol. 69, n. 8, 2009, pp. 3689–94, DOI : 10.1158/0008-5472.CAN-09-0024 , PMC 2669852 , PMID 19351816 .
- ^ Rabes HM et al. , Pattern of radiation-induced RET and NTRK1 rearrangements in 191 post-chernobyl papillary thyroid carcinomas: biological, phenotypic, and clinical implications , in Clin. Cancer Res. , vol. 6, n. 3, 2000, pp. 1093–103, PMID 10741739 .
- ^ Nikiforova MN et al. , Low prevalence of BRAF mutations in radiation-induced thyroid tumors in contrast to sporadic papillary carcinomas , in Cancer Lett. , vol. 209, n. 1, 2004, pp. 1–6, DOI : 10.1016/j.canlet.2003.12.004 , PMID 15145515 .
Bibliografia
- Léo Testut e O. Jacob, Trattato di anatomia topografica : con applicazioni medico-chirurgiche , 1: Testa, rachide, 2ª ed., Torino, Utet, 1977, ISBN 978-88-7051-287-8 .
- AE Paletto et al. , Nuovo trattato di tecnica chirurgica , 1 Generalità, collo, mammella, Torino, Utet, 1996, ISBN 978-88-02-05118-5 .
- G. Anastasi et al. , Trattato di anatomia umana , 4ª ed., Edi.Ermes, agosto 2007, ISBN 978-88-7051-287-8 .
- E. DeAntoni, Il carcinoma differenziato della tiroide. Collana Monografica della Società Italiana di Chirurgia , Torino, Utet, 2006.
- Robbins e Cotran, Le basi patologiche delle malattie. Patologia generale , 8ª ed., Elsevier, 2010, ISBN 978-88-214-3175-3 .
Voci correlate
- Classificazione TNM
- Metastasi
- Stadio tumorale
- Recettori accoppiati a chinasi
- Ecografia
- Tiroide
- Tiroidectomia
- Linfonodo
- Ormoni tiroidei
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su tumore della tiroide
Wikimedia Commons contiene immagini o altri file su tumore della tiroide
Collegamenti esterni
- American Thyroid Association (ATA) , su thyroid.org .
- European Thyroid Association (ETA) , su eurothyroid.com .
- Ambulatorio carcinoma tiroideo - policlinico Umberto I di Roma [ collegamento interrotto ] , su medicinasapienza.it .
- Endocrinochirurgia Forlì , su ausl.fo.it . URL consultato il 7 febbraio 2008 (archiviato dall' url originale il 31 maggio 2009) .
- Linee Guida dell' Associazione Italiana di Medicina Nucleare ed imaging molecolare (AIMN) per la terapia radiometabolica.
| Controllo di autorità | LCCN ( EN ) sh85135165 · GND ( DE ) 4140890-1 · NDL ( EN , JA ) 00566929 |
|---|