Sistem de completare
Sistemul complementului , împreună cu anticorpii , este un element esențial al sistemului imunitar în mecanismele de apărare umorală împotriva agenților infecțioși . Este un sistem de mediere umorală, format din aproximativ 30 de proteine circulante în sânge și membrană, capabil să interacționeze între ele și cu membranele celulare . În sânge, proteinele sunt prezente ca molecule inactive funcțional; după activare, acestea sunt capabile să interacționeze între ele, cu anticorpi sau cu membranele celulare, desfășurând multiple activități biologice care includ celulele ucigătoare. Activarea în cascadă a proteinelor sale solubile, care sunt denumite în mod convențional componente , se află la baza diferitelor activități biologice, cum ar fi liza celulară, bacteriană sau virală; aceste componente sunt introduse în membranele agenților patogeni provocând pori pe ele care duc la liză. În timpul activării complementului există, de asemenea, recrutarea diferitelor celule imunocompetente, cum ar fi celulele fagocitare ( monocite , macrofage , celule polinucleare ), limfocite B și limfocite T.
Istorie
Termenul de complement a fost folosit pentru prima dată în 1898 de către J. Bordet, care observase că, dacă incuba un amestec de bacterii cu anticorpi conținând ser îndreptat împotriva bacteriilor, acestea erau lizate (distruse); dacă, pe de altă parte, zerul a fost încălzit la o temperatură de 56 ° C liza nu a avut loc. Deoarece s-a demonstrat deja că anticorpii rezistă la încălzire, Bordet a emis ipoteza prezenței în ser a unei componente termolabile care a finalizat acțiunea anticorpilor și pe care a numit-o complement.
Activarea complementului
Ca și în cazul altor sisteme care funcționează în corp, cum ar fi cel al coagulării sângelui și cel al kininelor , activarea complementului are loc cu un mecanism numit cascadă pentru activarea secvențială a diferitelor componente complementare care circulă într-o formă inactivă.
Există trei căi distincte de activare a complementului, calea clasică , calea alternativă și calea lectinei , care începând din diferite momente conduc la proteoliza C3 cu formarea consecventă a convertazei C5. Din acest eveniment central, activarea celorlalte componente se desfășoară printr-o cale comună care duce la formarea complexului de atașare a membranei (MAC) , care, prin legarea la membranele celulare ale microorganismelor, determină liza lor osmotică . Așa cum se întâmplă adesea, numele reflectă etapele descoperirii, nu rolul real în cadrul organismului.
Calea clasică este activată prin legarea unor clase de anticorpi de antigenul relativ și, prin urmare, reprezintă un mecanism de imunitate umorală specifică. Calea alternativă este activată direct de unele proteine ale membranelor celulare ale microbilor și, prin urmare, face parte din mecanismele imunității înnăscute . Calea lectinei care leagă manoza utilizează manoză ca loc de atașare la membranele agenților patogeni.
Unele proteine prezente pe celulele gazdă normale inhibă activarea complementului și acest lucru minimizează efectul nociv pe care complementul l-ar putea avea asupra celulelor gazdă. Pe de altă parte, microorganismele nu posedă aceste proteine, prin urmare sistemul complementar își poate efectua pe deplin acțiunea asupra membranei lor.
Traseu clasic
Activarea căii clasice depinde de interacțiunea a trei proteine complementare, C1, C4 și C2, cu complexul antigen - anticorp . Reacția începe cu legarea C1 de imunoglobuline de tip IgG1, IgG3 și IgM atașate la un antigen multivalent. Prima componentă a complementului (C1) constă din trei componente secundare, C1q, C1r și C1s. C1q (compus din șase lanțuri dispuse radial ca o umbrelă) efectuează o acțiune de recunoaștere prin legarea specifică la regiunea Fc a imunoglobulinelor și pentru a o activa necesită legarea a două Fc simultan. Din acest motiv, IgM, care sunt pentamerice (5 subunități și deci 5 Fc), sunt mai eficiente decât IgG (care sunt monomerice) în activarea complementului, deoarece necesită o concentrație mai mică pentru a avea 2 Fc suficient de aproape pentru a interacționa cu un singur C1q. C1r și C1s (care sunt prezente în perechi organizate într-un tetramer C1r 2 -C1s 2 ) efectuează în schimb o acțiune enzimatică (serin-esterază): legarea a două sau mai multe lanțuri C1q de imunoglobuline activează C1r, care activează odată C1s. C1s clivează enzimatic a doua componentă a cascadei complementare C4 în două fracții: C4a care rămâne în circulație în plasmă și C4b care se leagă covalent de membrană asigurându-se că activarea continuă numai în prezența antigenelor sau cu imunocomplexul. C4b, la rândul său, activează C2 în două fracții: C2a și C2b. C2a astfel produs se leagă de cel anterior, dând naștere complexului C4b2a. C2 este singura componentă complementară cu nomenclatura fragmentelor inversate (în anii 1990 s-a propus schimbarea nomenclaturii în C4b2b): C2b intră în circulație, în timp ce C2a rămâne atașat de C4b și nu are activitate biologică. Complexul C4b2a constituie enzima numită C3 convertază a căii clasice, capabilă să se lege de C3 și să o scindeze. C3 este împărțit în C3a (o anafilotoxină care intră în circulație) și în C3b capabil să se lege atât de membrana bacteriană cu scopuri opsonizante, cât și de complexul C4b2a în sine, formând convertaza C5 a căii clasice.
C5 este clivat pentru a forma C5a și C5b. C5a este eliberat în circulație, în timp ce C5b leagă complementele C6 și C7, formând complexul C5b, 6,7 care, prin intermediul lui C7, se leagă de membrana patogenă. Apoi vin molecula C8, care se leagă de complex și se inserează în membrana celulară, și moleculele C9, care leagă complexul polimerizându-l. 10 până la 16 molecule de C9 se leagă pentru a forma un por pe membrană. Ultimul complex este numit „complex de atașare a membranei”.
Via lectinica
Calea lectinei, foarte asemănătoare cu calea clasică, este activată cu legătura dintre polizaharide prezente pe microbi și lectine sau ficoline circulante. Lectina de legare la manoză (MBL), H-ficolina și L-ficolina au omologii structurale cu subunitatea C1q: au „capete” care leagă în mod specific reziduurile de manoză , fucoză sau N-acetilglucozamină. Aceste tipuri de zaharuri, legate de proteine sau lipide, sunt prezente doar pe suprafețele celulare ale agenților patogeni, dar nu și pe suprafața celulară a vertebratelor (care conțin alte tipuri de zaharuri, cum ar fi acidul sialic ), permițând astfel discriminarea tipului de atac de membrană și pentru a declanșa activarea complementului exclusiv pe suprafața agentului patogen. Interacțiunea cu polizaharidele permite apoi legarea cu serina protează asociată MBL-Serine Protease ( MASP ), inclusiv MASP-1, MASP-2 și MASP-3. MASP-1 (sau MASP-3) și MASP-2 sunt strict omoloage cu C1r și C1 și, odată ce MBL (sau ficolinele) sunt legate, formează tetrameri și scindează C4 și C2, reunind celelalte etape ale traseului clasic.
Mod alternativ
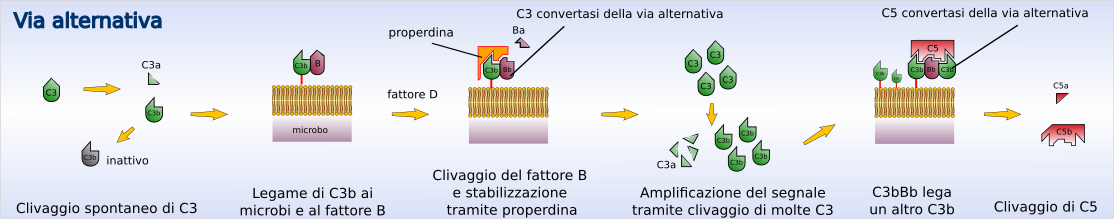
Activarea căii alternative duce la formarea proteazei C3 și, prin urmare, la scindarea C3 fără contribuția anticorpilor. În condiții normale, divizarea C3 în circulație are loc continuu la o rată foarte lentă ( tickover ) cu formarea unor cantități foarte mici de C3b (care are omologii structurale cu C4b). Dacă aceasta rămâne în circulație, este rapid inactivată; dacă în schimb se leagă de suprafețele celulare, de exemplu bacteriene, se poate lega de o proteină plasmatică numită factor B. De îndată ce se leagă de C3b, factorul B pierde un fragment mic (fragment Ba) de o protează numită factor D. Fragmentul reziduul, Bb, rămâne legat de C3b constituind complexul C3b-Bb care reprezintă convertaza C3 a căii alternative. Acest mod se mai numește „via della properdina”. Properdin (sau factorul P) este o proteină plasmatică care, datorită afinității sale cu aceste molecule, leagă complexul C3b-Bb, stabilizând convertaza C3 și crescându-și timpul de înjumătățire de la 4 la 40 de minute. [1] În locul proprietei, se poate lega și o altă subunitate C3b, formând complexul C3bBbC3b numit și convertaza C5 a căii alternative. C3 convertaza este capabilă să descompună cantități mari de C3 prin amplificarea rapidă a procesului, dar numai dacă complexul C3bBb se formează pe membranele bacteriene și nu pe celulele de mamifere , deoarece acestea din urmă posedă proteine care degradează convertaza C3 prin oprirea cascadei.
Detalii moleculare ale C3
C3 este un factor de complement prezent în plasma sanguină la concentrații mari, constând din două lanțuri, β (reziduuri 1-645) și α (reziduuri 650-1641), care formează împreună 13 domenii, dintre care 6 (MG1, MG2, MG3, MG4, MG5, LNK) aparținând lanțului β și altor 6 (ANA, MG7, CUB, TED, MG8, C345C) aparținând lanțului α, în timp ce doar un domeniu (MG6) este format pe jumătate de lanțul α (MG6 α ) și pentru restul din lanțul β (MG6 β ) [2] .
Dintre aceste 13 domenii, 8 (5,5 din lanțul β și 2,5 din α) prezintă o înfășurare similară cu modulul structural al fibronectinei de tip 3 (derivat din modulul structural asemănător imunoglobulinei ), deși nu este evidentă nicio omologie de secvență între aceste domenii. Astfel, în analogie cu domeniile imunoglobulinei, aceste 8 domenii ale C3 sunt menționate cu acronimul MG ( domeniile macroglobulinei : MG1 - MG8) [2] .
C3 are caracteristica de a deține o legătură tioesterică foarte reactivă ( Cys 988-Gln 991 ), deoarece este instabilă într-un mediu apos, iar mecanismul formării sale, cu eliberarea consecutivă de amoniac, a făcut obiectul multor publicații [3] ] , dar unele rezultate sugerează că reziduurile Cys 988 și Gln 991 , în timpul sau în urma sintezei proteinei, pot reacționa spontan, ducând la tioesterul necesar activității biologice a proteinei C3: fără îndoială, formarea acestei legătura implică participarea structurilor adiacente care formează un sit activ care promovează reacția dintre Cys 988 și Gln 991 , iar înfășurarea lui C3 este capabilă să furnizeze atât energia cât și mediul necesar reacției dintre aceste două reziduuri [ 3] .
În forma neclivită a C3 (C3 nativ ), acest grup tioester este protejat de apă datorită unui buzunar hidrofob format din reziduurile Met 1378 , Tyr 1425 și Tyr 1460 din domeniul MG8 (reziduuri 1331-1474 pe lanțul α de C3) și Phe 1047 din domeniul TED (domeniul care conține tioester sau domeniul tioester : reziduuri 963-1268 pe lanțul C3 α ) [2] , ceea ce face tioesterul extrem de stabil la hidroliză la pH 7,4 (t 1/2 > 6 zile) [4] sau la atacul altor nucleofili mici. Deși complet îngropate, tioesterul și buzunarul de protecție sunt situate la interfața TED-MG8 lângă suprafața proteinei [2] , iar instabilitatea tioesterului determină o liză spontană lentă, dar constantă a C3, cunoscută sub numele de tickover , ceea ce, totuși, face nu conduc întotdeauna la activarea complementului, deoarece C3b generat poate fi de asemenea dezactivat direct în faza apoasă a sângelui sau poate fi inactivat de prezența proteinelor de reglare a activării complementului, prezente constitutiv pe membranele celulelor de mamifere, dar absente în cele ale microorganismelor (vezi mai jos ).
După scindarea operată de enzima C3-convertază , grupa tioesterică este expusă și, prin urmare, destabilizată de mediul apos înconjurător, astfel încât fragmentul C3b rezultat ( opsonina ) poate fi de exemplu hidrolizat (inactivat) în sânge sau poate reacționa cu grupe amino sau hidroxil de proteine sau polizaharide prezente pe toate suprafețele celulare (în special, membranele bacteriilor), generând legături covalente, respectiv, amidă sau ester ( opsonizare ), care facilitează fagocitoza operată de celule ale imunității nespecifice a sistemul imunitar , cum ar fi macrofagele și neutrofilele care exprimă receptorii CR (receptori complementari) [5] specifici pentru C3b pe suprafața lor.
Activarea complexului litic
După cum este ilustrat, cele trei căi de activare complementare, clasica, alternativa și lectina, conduc la constituirea a două complexe diferite, C4b2a și C3bBb, dar cu o funcție identică: aceea de a împărți C3 în două fragmente., C3a și C3b, și să se lege de C3b formând convertazele C5. Convertazele C5 originate declanșează activarea componentelor finale ale sistemului complementului care duc la formarea MAC ( Complex de atac de membrană ) și distrugerea celulei.
Convertazele C5 scindează (împart) C5 în două fragmente: C5a care rămâne în soluție îndeplinind funcții importante și C5b care se leagă de celelalte proteine complementare deja prezente pe membrană. În acest context, C5b menține o conformație temporară care permite legarea celorlalte două proteine complement C6 și C7 formând complexul C5b, 6,7. Odată legat, C7 (care este hidrofob) se inserează în bistratul lipidic al membranei microbiene unde devine un receptor pentru C8 (următoarea componentă). Odată legat, C8 (cu o parte din el) este de asemenea introdus în membrană, definind complexul C5b, 6,7,8 (sau C5b-8). Ultimul pas pentru formarea unui MAC activ este legarea cu C9 care în asociere cu complexul C5b-8 polimerizează și formează un por în membrana bacteriană în mod similar cu perforina eliberată de limfocitele citotoxice și NK T. Prin porii produși de polimerizarea C9, apa și ionii au acces gratuit la interiorul celulei, provocând mai întâi umflarea osmotică și apoi izbucnirea acesteia.
Ajustare
Pentru a împiedica sistemul complementului să câștige mâna, în special prin activarea pe celulele organismului, există o serie de proteine circulante din familia regulatorilor complementului , RCA (Regulatori ai activității complementului).
- C1 INH (inhibitor C1): este o proteină plasmatică care poate fi scindată din complexul C1r 2 -C1s 2 și se leagă imediat de acesta, blocând astfel etapele ulterioare. Acționează ca un inhibitor competitiv.
- inhibitori ai asamblării convertazei C3 și C5: aceste proteine se leagă de C3b sau C4b blocând legarea cu alte componente ale convertazei (Bb și respectiv C2a). Ele sunt prezente constitutiv pe membranele celulelor de mamifere, dar absente în cele ale microorganismelor. Exemple sunt: CR1, DAF (Decay-Accelerating Factor, or CD55), C4BP (C4 Binding Protein), MCP (Membrane Cofactor Protein, or CD46) și așa-numitul factor H. Acesta din urmă acționează datorită prezenței acidului sialic pe membrana celulelor corpului care favorizează legarea factorului H de C3b mai degrabă decât a factorului B.
- Factorul I: este o proteină serin proteazică capabilă să degradeze fragmentul C3b, dar numai în prezența proteinelor descrise mai sus. Acțiunea factorului I determină formarea de fragmente iC3b, C3d și C3dg inactive care rămân la suprafață și pot fi recunoscute de fagocite și limfocite B.
- Inhibitori ai formării MAC: important pentru a împiedica formarea MAC să se deplaseze către celulele adiacente celei direct afectate. Exemple sunt CD59 care previne legarea fracției C9 și proteinei S care leagă complexul C5b, 6,7 inhibând inserția acestuia în membrane.
Consecințele biologice ale activării complementului
Activarea complementului generează formarea unui număr mare de produse cu diferite activități biologice: unele sunt depuse pe suprafața particulelor de activare, provocând liza lor (complexul MAC) sau fagocitoza (C3b). Alții precum C3a și C5a provoacă o reacție inflamatorie locală. Prin aceste activități complementul joacă un rol foarte important în sistemul de apărare umorală împotriva agresiunilor externe.
Opsonizare, fagocitoză și liză
Fragmentele C3b sau C4b, derivate din activarea căii clasice sau a căii alternative complementare, acoperă microorganismul care a provocat activarea acestuia și prin legarea la receptorii specifici relativi exprimați pe neutrofile și macrofage, îi activează fagocitoza , adică încorporarea microorganism din interiorul acestor celule. În general, legarea singură cu proteinele complementului nu este suficientă pentru a induce fagocitoza, care este activată eficient prin legarea imunoglobulinelor (anticorpilor).
Complexul de atașare a membranei (MAC) este responsabil pentru liza osmotică a celulelor străine, permițând complementului să aibă o acțiune directă asupra microorganismelor, precum și sprijin pentru alte specii de celule.
Inducerea răspunsului inflamator
Proteoliza componentelor C3, C4 și C5 generează fragmentele relative relative care se asamblează împreună în diferitele faze de activare a complementului și fragmentele C3a, C4a și C5a, numite anafilotoxine. Acestea induc inflamații prin atașarea lor la receptorii relativi ai membranei prezenți pe mastocite , granulocite (neutrofile, bazofile, eozinofile), monocite și pe celulele endoteliale . În toate acestea, cel mai puternic este C5a, cu o putere de 20 și 2.500 de ori mai mare decât C3a și C4a. Principalele acțiuni rezultate sunt următoarele:
- catarg de celule degranularea cu eliberarea de mediatori vasoactivi.
- creșterea permeabilității vasculare prin acțiune directă asupra celulelor endoteliale.
- exprimarea crescută a P-selectinei pe endoteliu pentru a facilita chemotaxia neutrofilelor și aderența acestora la celulele endoteliale.
În plus, există unele componente (în principal C3b și C5a) care stimulează activarea și atașarea la endoteliul celulelor fagocitice și a ucigașilor naturali.
Prin urmare, paragraful poate fi rezumat spunând că sistemul complementar implică o amplificare și consolidare a răspunsului imun înnăscut.
Eliminarea complexelor imune antigen-anticorp cauzate de hipersensibilitate de tip III
În urma răspunsului imun îndreptat către un antigen solubil specific, individul reacționează cu formarea de anticorpi; acestea se leagă de antigenul relativ cu formarea de complexe imune circulante (complexe antigen-anticorp). Dacă sunt de dimensiuni adecvate și în cantitate suficientă, complexele imune se pot depune pe pereții vaselor, favorizând o reacție inflamatorie dăunătoare organismului. Complementul prin legarea la acești complecși promovează solubilizarea și îndepărtarea lor de către celulele fagocitare.
la nivel sistemic, o boală cauzată de o acumulare de complexe imune este lupusul eritematos sistemic, depunere care se produce pe tot corpul, provocând inflamații sistemice cronice
Activarea limfocitelor B.
O proteină produsă în clivajul C3, numită C3d, interacționează cu receptorul respectiv CR2 (CD21) exprimat pe membrana limfocitelor B, declanșând inițierea răspunsului umoral, adică producerea de anticorpi.
Patologii
Aproape toate patologiile legate de defectele complementului se datorează deficiențelor genetice ale proteinelor implicate. Au fost descrise deficite pentru toate componentele sistemului (inclusiv regulatoare), deși unele foarte rare:
- C2 și C4: este cel mai frecvent și 50% dintre cei afectați dezvoltă lupus eritematos sistemic fără a avea o susceptibilitate crescută la infecții.
- C3: este însoțit de infecții severe și recurente, adesea letale.
- C5, C6, C7, C8 și C9: duce la lipsa lizei mediate de complement, deosebit de importantă pentru apărarea împotriva infecțiilor cu Neisseria meningitidis și Neisseria gonorrhoeae .
- C1 INH: determină un clivaj necontrolat al C2 și C4 ducând la edem angioneurotic ereditar .
Hemoglobinuria nocturnă paroxistică este singurul sindrom neereditar cauzat de o mutație a DAF și CD59 care apare în timpul hematopoiezei .
Se utilizează în diagnosticare
Testul de fixare a complementului este o metodologie de diagnosticare indirectă pentru bolile infecțioase, care vizează căutarea anticorpilor împotriva unui antigen specific. De exemplu, este unul dintre testele oficiale pentru diagnosticarea brucelozei.
Proteinele complementului prezente în mod natural în serul de testat trebuie eliminate prin plasarea godeului cu serul într-o baie de apă la 56 ° C timp de 30 de minute. Antigenul și complementul sunt apoi adăugate și incubate peste noapte la 4 ° C. Celulele roșii din oaie sunt apoi adăugate împreună cu anticorpi împotriva globulelor roșii din oaie și se lasă să se incubeze timp de 30 de minute.
Dacă nu s-au căutat anticorpi, complementul a fost folosit de acele celule roșii din sânge care, prin urmare, au fost lizate prin colorarea fântânii cu roz (test negativ), dacă în schimb au existat au folosit complementul în detrimentul acelor anti sânge celule roșii care rămân întregi și clar vizibile ca un petic roșu pe fundul puțului (test pozitiv)
Dacă diluțiile seriale sunt făcute în mai multe godeuri, poate fi de asemenea utilizat pentru a titra concentrația de anticorpi
Notă
- ^ Biologia sistemului imunitar: sistemul complementului pe www.msd-italia.it.
- ^ a b c d Bert JC Janssen, Eric G. Huizinga, Hans CA Raaijmakers, Anja Roos, Mohamed R. Daha, Kristina Nilsson-Ekdahl, Bo Nilsson & Piet Gros, Structurile componentei complementului C3 oferă informații despre funcția și evoluția imunitate , în natură , vol. 437, nr. 7059, pp. 505-511.
- ^ a b MK Pangburn, Reforma spontană a tioesterului intramolecular în proteina C3 a complementului și captarea la temperatură scăzută a unui intermediar conformațional capabil de reformare. , în Jurnalul de chimie biologică , vol. 267, nr. 12, 1992, pp. 8584-8590.
- ^ MK Pangburn, RD Schreiber, HJ Müller-Eberhard, Formarea convertazei inițiale C3 a căii alternative complementare. Achiziționarea de activități asemănătoare C3b prin hidroliza spontană a tioesterului putativ în C3 nativ. , în Jurnalul de Medicină Experimentală , vol. 154, n. 3, 1981, pp. 856-867.
- ^ Zanichelli Pro Dictionary of Medicine and Biology, Complement receptor , pe Medicina.zanichellipro.it , Zanichelli Editore spa (arhivat dinoriginal la 13 septembrie 2014) .
Bibliografie
- Abul K. Abbas, Andrew H. Lichtman, Jordan S. Pober. Imunologie celulară și moleculară . Padova, Piccin, 2002. ISBN 88-299-1622-6
- Abul K. Abbas, Andrew H. Lichtman, Shiv Pillai. Imunologie celulară și moleculară . Elsevier, 2012
- Abul K. Abbas, Andrew H. Lichtman. Bazele imunologiei. Funcții și modificări ale sistemului imunitar . Padova, Piccin, 2002.
- Jean-François Bach, Philippe Lesavre. Imunologii . Paris, Flammarion Sciences Médecine, 1981.
- Giuseppe Tridente. Imunologie și imunopatologie . Roma, Gândirea științifică, 1981.
- Lorenzo Bonomo. Imunologie clinică . Torino, UTET, 1992. ISBN 88-02-04544-5 .
Elemente conexe
linkuri externe
- ( EN ) Sistem de completare , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
- Biologia sistemului imunitar: sistemul complementului pe www.msd-italia.it
| Controllo di autorità | Thesaurus BNCF 53441 · LCCN ( EN ) sh85029354 · GND ( DE ) 4120589-3 · BNF ( FR ) cb119580971 (data) · NDL ( EN , JA ) 00563548 |
|---|