Zinc
| Zinc | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspect | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generalitate | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numele, simbolul, numărul atomic | zinc, Zn, 30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | metale de tranziție | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group , perioada , bloc | 12 , 4 , d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitate | 7 140 kg / m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duritate | 2.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurare electronică | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termen spectroscopic | 1 S 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți atomice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Greutate atomica | 65.409 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raza atomică (calc.) | 135 (142) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raza covalentă | Ora 13:00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raza Van der Waals | 139 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurare electronică | [ Ar ] 3d 10 4s 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| și - pentru nivelul de energie | 2, 8, 18, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stări de oxidare | 2 (amfoteric) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structură cristalină | hexagonal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți fizice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stare a materiei | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de fuziune | 692,68 K (419,53 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de fierbere | 1 180 K (910 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumul molar | 9,16 × 10 −6 m³ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia vaporizării | 115,3 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Căldura de fuziune | 7,322 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presiunea de vapori | 192,2 Pa la 692,73 K. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Viteza sunetului | 3 700 m / s la 293,15 K. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Alte proprietăți | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| numar CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitate | 1,65 ( scară Pauling ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Căldura specifică | 390 J / (kg K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductibilitate electrică | 16,6 × 10 6 / (m Ω ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitate termică | 116 W / (m K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia primei ionizări | 906,4 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A doua energie de ionizare | 1 733,3 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A treia energie de ionizare | 3 833 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia celei de-a patra ionizări | 5 731 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopi mai stabili | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ISO: izotop NA: abundență în natură TD: timp de înjumătățire DM: modul de descompunere DE: energia de descompunere în MeV DP: produs de descompunere | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Zincul este elementul chimic cu numărul atomic 30 și simbolul său este Zn .
Zincul este solid la temperatura camerei . Este un metal moderat reactiv , care se combină cu oxigenul și alte nemetale ; reacționează cu acizi diluați pentru a genera hidrogen . Singura stare de oxidare a zincului este +2. Are caracteristici similare calciului , dar reactivitate mai mică.
În prezența ditizonei, acesta își asumă o culoare roșie intensă. Zincul este un oligoelement esențial, prezent în organism în cantități mai mari decât orice alt oligoelement, altul decât fierul .
fundal
Aliajele de zinc au fost folosite de secole: alama este probabil cea mai veche și artefacte din acest aliaj se găsesc în Palestina între 1400 și 1000 î.Hr. [ citație necesară ] Obiecte de 87% zinc pur au fost găsite în Transilvania preistorică. Datorită punctului de fierbere scăzut și a reactivității chimice a acestui metal (zincul pur tinde să se evapore mai degrabă decât să se colecteze sub formă lichidă) adevărata natură metalică a acestui element nu a fost recunoscută de către antici.
Fabricarea alamei era cunoscută de romani în jurul anului 30 d.Hr., cu o tehnică care presupunea încălzirea cuprului și a calaminei într-un creuzet. Căldura a redus oxizii de zinc ai calaminei, iar zincul liber a fost captat de cupru, formând alamă, care a fost apoi turnată în matrițe sau forjată.
Extragerea și utilizarea formelor impure de zinc a fost practicată încă din 1000 î.Hr. în China și India ; la sfârșitul secolului al XIV-lea , hindușii erau conștienți de existența zincului ca un metal în sine, diferit de cele șapte metale cunoscute de antici. În Occident, descoperirea zincului metalic pur pare să se datoreze germanului Andreas Marggraf , în 1746, deși întreaga poveste are unele laturi fictive.
Descrieri despre cum să obțineți alamă se găsesc în Europa de Vest în scrierile lui Albert cel Mare (c.1248), iar până în secolul al XVI-lea , cunoașterea și utilizarea noului metal s-au răspândit pe scară largă. În 1546 Agricola a observat că în cuptoarele în care fuseseră topite pâini de zinc, un metal alb condensat pe pereți care putea fi recuperat prin răzuirea acestuia; în notițele sale a adăugat că în Silezia se pregătea un metal foarte asemănător, numit zincum . Paracelsus (mort în 1541) a fost primul din Occident care a observat că zincul era de fapt un metal nou și că avea un set de proprietăți chimice separate de cele ale celorlalte metale cunoscute. Deci, zincul era deja cunoscut când Marggraf și-a făcut descoperirea și, de fapt, zincul fusese deja izolat cu doi ani înainte de un alt chimist, Anton von Swab. Cu toate acestea, calitatea și acuratețea metodică a relațiilor sale exhaustive au fost de natură să-i consolideze faima de descoperitor al zincului.

Înainte de descoperirea tehnicii de flotație a sulfurii de zinc, calamina era principala sursă de zinc metalic.
Caracteristici
În aer, zincul este acoperit cu o patină care protejează straturile subiacente. Rezistența mecanică este scăzută și duritatea mai mică decât cea a cuprului.
Disponibilitate
Zincul este cel de-al douăzeci și treilea element cel mai abundent din scoarța terestră ; cele mai exploatate zăcăminte de zinc conțin de obicei 10% fier și 40% -50% zinc. Mineralele din care se extrage zincul sunt sfaleritul (sau blenda), smithsonitul , calamina și franklinitul .
Există mine de zinc peste tot în lume și cei mai mari producători sunt Australia , Canada , China , Peru și Statele Unite . În Europa , cele mai importante două mine sunt Vieille Montagne din Belgia și Zinkgruvan în Suedia .
| Principalii producători de zinc în 2019 [1] | ||
|---|---|---|
| Poziţie | țară | Producție (tone) |
| 1 | | 4 210 000 |
| 2 | | 1 400 000 |
| 3 | | 1.330.000 |
| 4 | | 753 000 |
| 5 | | 720 000 |
| 6 | | 677 000 |
| 7 | | 520 000 |
| 8 | | 336 000 |
| 9 | | 304 000 |
| 10 | | 260 000 |
| 11 | | 245 000 |
| 12 | | 163 000 [2] |
Extracţie
Zincul este al patrulea metal cel mai des utilizat în utilizarea tehnologică după fier , aluminiu și cupru , pe tone de metal produse anual.
Extracția zincului se realizează în conformitate cu două procedee diferite: prin metoda termică sau electrolitică.
Traseu termic
Mineralele de zinc sunt oxidate cu aer , conform reacției:
- 2ZnS + 3O 2 → 2ZnO + 2SO 2
oxizii de zinc sunt apoi reduși termic, în funcție de reacție:
- 2ZnO → 2Zn + O 2
În acest fel, zincul metalic este produs în faza de vapori ; pentru a- l condensa ulterior este necesar să îl extrageți împreună cu plumbul , ceea ce împiedică reacția să se întoarcă spre oxidul de zinc; plumbul și zincul sunt apoi separate într-o coloană de distilare funcționând la o temperatură de aprox 750 ° C în carbură de siliciu , din care se obțin zinc și plumb aproape pur în stare topită.
Prin electrolit
Oxidul de zinc este levigat cu acid sulfuric conform reacției:
- ZnO + H 2 SO 4 → ZnSO 4 + 2H +
și trimise la o celulă electrolitică care conține o soluție de sulfat de zinc ca electrolit ; anodul este alcătuit dintr-o placă de plumb, în timp ce catodul este alcătuit dintr-o placă de zinc pur; reacția generală este:
- ZnSO 4 + H 2 O → Zn + H 2 SO 4 + 1 / 2O 2
obținerea de catoduri de zinc pur.
Izotopi
Zincul în natură este compus din 5 izotopi : 64 Zn (cel mai abundent, 48,6%), 66 Zn, 67 Zn, 68 Zn și 70 Zn.
Izotopii 66 Zn, 67 Zn și 68 Zn sunt stabili, în timp ce 64 Zn și 70 Zn au timp de înjumătățire (respectiv estimat în 2,3 × 10 18 și 1,3 × 10 16 ani) mult mai mare decât vârsta estimată a universului , acest lucru permite ignorarea radioactivității lor relative și considerarea lor, în practică, ca stabilă.
Au fost sintetizați și studiați încă 22 de radioizotopi , dintre care cel mai stabil este 65 Zn cu un timp de înjumătățire de 244,26 zile și 72 Zn cu un timp de înjumătățire de 46,5 ore. Toți ceilalți izotopi sunt radioactivi, cu timp de înjumătățire mai mic de 14 ore, iar majoritatea dintre aceștia au timp de înjumătățire mai mic de o secundă. Zincul are, de asemenea, 4 stări metastabile .
Izotopul de 54 Zn, cu un timp de înjumătățire de doar 3,7 milisecunde, se poate descompune emițând doi protoni , o modalitate extrem de rară, posibilă numai pentru nucleii atomici cu un număr par de protoni și lipsit puternic de neutroni. Singurul alt nucleu atomic care prezintă acest fenomen este 45 Fe.
Compuși
- Oxidul de zinc este probabil cel mai cunoscut și cel mai utilizat compus de zinc: formează o bază excelentă pentru pigmenții albi și se găsește în multe vopsele. Este, de asemenea, utilizat în industria cauciucului și este vândut ca protecție solară. O mare varietate de alți compuși își găsesc aplicarea în multe sectoare ale industriei. Clorura de zinc este utilizată în deodorante; sulfura de zinc în vopselele fosforescente, iar metil zincul este utilizat ca reactiv în chimia organică. Aproximativ un sfert din toată producția mondială de zinc este utilizată sub formă de compuși de zinc.
- Iodură de zinc
- Sulfat de zinc
- Sarea de zinc, în acid acetic , devine acetat de zinc .
Aplicații
- Zincul este utilizat pentru galvanizarea metalelor precum oțelul, pentru a preveni coroziunea.
- Zincul este utilizat în aliaje precum alama , nichel argintiu, metalul pentru mașină de scris, diverse aliaje de lipit , argintul german etc.
- O familie de aliaje de zinc cunoscută în mod obișnuit sub numele de zamak este utilizată pentru a produce, prin intermediul tehnologiei de turnare sub presiune , piese turnate destinate diferitelor utilizări (piese auto, aparate de uz casnic, jucării, nasturi și balamale).
- Foi laminate de zinc fac parte din recipientele pentru baterii Leclanchè.
- Oxidul de zinc este utilizat ca pigment alb în vopselele și vopselele pe bază de apă și ca activator în industria cauciucului . Sub formă de unguent, oxidul de zinc este aplicat într-un strat subțire pe pielea nasului și a obrajilor pentru a preveni deshidratarea și astfel îl protejează de soare vara și de îngheț iarna. Aplicându-l în zona perineală a nou-născuților la fiecare schimbare, îi protejează de iritarea pielii. Conform studiilor clinice privind pierderea vederii la persoanele în vârstă, oxidul de zinc este o parte importantă a tratamentului eficient pentru unele cazuri de degenerescență maculară legată de vârstă . [ fără sursă ]
- Clorura de zinc este utilizată ca deodorant, în tratamentul unor probleme ale gingiilor și ca conservant pentru lemn .
- Sulfura de zinc este utilizată în pigmenții luminescenți pentru a face strălucirea mâinilor ceasurilor și a altor obiecte în întuneric.
- În chimia organică, organozincatele au un număr mare de aplicații pentru sinteza moleculelor, ca în reacția de cuplare Negishi
- Loțiunile de calamină , un amestec de Zn- (hidroxi-) carbonați și silicați, sunt utilizate pentru a trata iritațiile pielii [3] .
- Zincul metalic este inclus în majoritatea suplimentelor de vitamine și minerale de pe piață: alături de alte metale, unii cred că are proprietăți antioxidante, care protejează împotriva îmbătrânirii pielii și a mușchilor. În cantități mai mari, sau luate singur ca în unele preparate de zinc, se crede că accelerează procesul de vindecare a daunelor fizice.
- Gluconatul de zinc este luat în tablete ca remediu pentru răceala obișnuită.
- Zincul este utilizat în aliaje pentru producția de aur și argintărie.
- Odată ce acest metal a fost folosit, fiind mai ieftin, pentru a construi conductele mai mari ale organelor ; această practică a fost aplicată în special în perioada care a început de la primul postbelic (1918) până la sfârșitul anilor cincizeci, apoi a fost aruncată din motive acustice, revenind la construirea conductelor în aliajul tradițional de construcție a organelor, realizat dintr-o variabilă amestec de staniu și plumb în funcție de tipul de registru căruia îi aparține butoiul în construcție.
- Zincul este, de asemenea, utilizat ca anod de sacrificiu în protecția catodică , o tehnică specială anticorozivă .
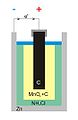
O tablă de oțel zincat
Lingouri în zamak (un aliaj pe bază de zinc)
Diagrama bateriei zinc-carbon (denumită „ grămadă Leclanché ”)
Metalurgia industrială
Acoperiri de protecție
Zincul este de obicei folosit pentru acoperirea pieselor metalice pentru a le proteja de coroziune; această acoperire se poate face prin:
- Metalizare (pulverizare): zincul pur este introdus într-un pistol cu suflantă sau cu pistol de acetilenă, care vaporizează zincul metalic care este apoi depus pe piesa care urmează să fie acoperită. Această metodă este foarte rapidă și ieftină și poate fi realizată direct la fața locului. Grosimea acoperirii astfel obținute este ridicată și nu este omogenă.
- Scufundare la cald : aliajul de zinc cu 5% aluminiu este topit și piesele care trebuie acoperite sunt scufundate în baia topită; zincul topit udă piesa, creând următoarele faze:
- Zn η ( rețea hexagonală compactă )
- ZnFe ζ ( zăbrele tetragonale )
- ZnFe δ ( rețea cubică centrată pe corp )
- ZnFe γ ( rețea cubică centrată pe față )
Această acoperire, numită zincare , este foarte coerentă, dar grosimea sa este ridicată și neuniformă; în plus, temperatura băii topite ar putea induce tratamente termice în piesa de acoperit. Boabele finale sunt foarte grosiere, vizibile chiar cu ochiul liber.
- Sherardizare (acoperire mecanică): piesele care urmează să fie acoperite sunt plasate într-un tambur rotativ la temperatură ridicată împreună cu fulgi de sticlă și ZnFe, obținuți din deșeuri de scufundare la cald; pe piese se formează o acoperire care conferă rezistență la coroziune și uzură.
- Galvanizare : piesa este introdusă într-o celulă galvanică care acționează ca un catod, în timp ce o bucată de zinc pur este utilizată ca anod solubil; o soluție alcalină sau acidă de sulfat de zinc poate fi utilizată ca electrolit (utilizat pentru a face compoziția electrolitul); de obicei se folosesc electroliți acizi deoarece au supratensiuni mai mari datorită impurităților prezente inevitabil, împiedicându-le să se depună; de asemenea, conduc electricitatea mai bine și permit un consum mai mic de energie electrică pentru proces.
Prin galvanizare se obțin grosimi foarte omogene și mici, chiar și pe bucăți de formă complexă; în plus, boabele cristaline sunt foarte mici și duc la o luciu de suprafață estetic plăcut; temperatura soluției este, de asemenea, destul de scăzută (maxim 80 ° C) și nu poate induce tratamente termice în piesele care trebuie acoperite; cu toate acestea, trebuie acordată atenție posibilelor efecte de margine generate de asimetrii în piesa care trebuie acoperită.
Piesa care trebuie acoperită trebuie să fie periată anterior, degresată, curățată de orice oxidare a suprafeței prin decapare pentru a asigura aderența maximă la acoperirea cu zinc, a cărei funcție este de a proteja împotriva coroziunii, prin:
- strat de suprafață de oxid de zinc (ZnO), care la temperaturi scăzute este protector și protejează împotriva oxidării ulterioare;
- protecție fizică împotriva coroziunii stratului de zinc metalic de pe piesa de prelucrat;
- protecție electrochimică împotriva coroziunii; în cazul deteriorării primelor două straturi de suprafață, metalul piesei ar fi expus; atunci s-ar forma un cuplu galvanic între Mine și Zn; dar zincul are o electronegativitate foarte scăzută și s-ar comporta ca un anod, corodându-se în locul metalului care trebuie protejat.
Zinc superplastic
Pentru un aliaj de zinc cu 21-23% aluminiu și 0,4-0,6% cupru, putem obține un comportament superplastic, similar cu sticla topită sau cauciucul, printr-un tratament de solubilizare la o temperatură între 275 și 375 ° C urmat de stingere și îmbătrânire la temperatura sub 275 ° C: se formează un bob cristalin foarte fin care conferă aliajului proprietăți superplastice; dacă se depășește temperatura de 275 ° C, aliajul își pierde toate proprietățile sale superplastice;
Aliaje de turnătorie
Sunt de obicei aliaje de zinc-aluminiu cu mai puțin de 5% aluminiu; conferă aliajului o rezistență mai bună la coroziune, cu excepția mediilor de reducere și caracteristici mecanice superioare zincului pur. Structurile dendritice se formează în timpul solidificării, ușor sensibile la tensiunea și tensiunea termică; Tratamentele de recoacere vor fi necesare și pentru piesele obținute în turnare sub presiune.
Monedă în zinc

Zincul a fost folosit de secole în monede pentru a crea aliaje, dar momentul de cea mai mare difuzie a fost perioada de război din anii 1900.
În timpul primului război mondial, cu lipsa de metale pentru utilizare în război, unele țări au înlocuit monedele de cupru, bronz și argint cu monede din aluminiu și / sau zinc. Una dintre primele națiuni care a adoptat moneda de zinc a fost Germania, care a adoptat zincul în 1916 pentru moneda mai mică de 10 pfennigs . Dar Belgia și Luxemburgul și-au înlocuit cenții de cupru cu monede de zinc în perioada ocupației germane din primul război mondial 1915 - 1918 .

Chiar și în perioada postbelică, Germania a continuat să producă monede / jetoane de zinc numite Notgelds și, în același timp, monedele din Orașul liber Gdansk , precum și cele din Polonia și Bulgaria au fost, de asemenea, bătute în zinc. În timpul celui de- al doilea război mondial , țările aflate sub sfera de influență a celui de-al III - lea Reich au bătut monede de zinc, cum ar fi Franța , în special în Republica Vichy , Croația , Ungaria , România , Serbia , coloniile franceze din Indochina , Siria , Liban și Tunisia . După dezmembrarea Cehoslovaciei , Hitler a creat un stat marionetă Protectoratul Boemiei și Moraviei, a cărui monedă a fost bătută exclusiv în zinc și Slovacia, care a bătut moneda de 5 halierov în zinc.
Chiar și țările îndepărtate de război, precum Elveția și Bolivia, s-au adaptat la monedele de zinc. Mai târziu și toate țările ocupate de Germania nazistă: Belgia, Țările de Jos , Danemarca , Norvegia și chiar îndepărtata Islandă . Alți cobelligeranți au folosit pe scurt monede de zinc, cum ar fi centul american "Lincoln" în 1943 și 1, 5 și Japonia 10 ¥ dar numai în 1944 . Alte țări, în ultima perioadă, au continuat să emită monede de zinc, cum ar fi Peru , unul dintre cei mai mari producători de metal din lume, Albania , Danemarca și Austria înainte de Euro .
Importanța biologică
Zincul este un element esențial pentru viața oamenilor și a animalelor superioare: o deficiență de zinc afectează puternic creșterea corporală și creșterea în greutate. Zincul constituie părți ale proteinelor cu degete de zinc și enzime cu acțiune antioxidantă, cum ar fi superoxid dismutaza sau cu funcții catalitice, cum ar fi anhidrază carbonică, alcool dehidrogenază și dehidrogenază lactică. Potrivit unor surse, administrarea de tablete de zinc vă poate oferi o oarecare imunitate la răceli și gripă , dar acuratețea acestor informații este controversată. Mai mult, zincul este implicat în funcționarea vederii, mirosului, atingerii și memoriei și este responsabil pentru buna funcționare a acestora, iar un deficit de zinc provoacă disfuncționalități.
La bărbați, zincul este un element important pentru producerea spermei : până la 5 mg de zinc se pot pierde într-o singură ejaculare. O deficiență de zinc poate provoca o scădere a numărului de spermatozoizi din material seminal și invers, ejaculațiile foarte frecvente pot provoca o deficiență de zinc.
Rezervele scăzute de zinc sunt responsabile pentru scăderea volumului spermei și a nivelului de testosteron .
Studiile de la Universitatea din Ohio [4] arată că deficiența de zinc la șoareci a crescut drastic nivelul inflamației și ulterior in vitro pe celulele umane care scade nivelurile proteinei NF-κB, un factor central în răspunsul imun: de aici, ipoteza că zincul funcționează ca un imunomodulator. Proteina NF-κB transportă zincul în celulele sistemului imunitar care răspund mai întâi la infecții.
Efecte secundare
Zincul este necesar de majoritatea metaloproteazelor , care guvernează vascularizația tumorii. Un studiu corelează excesul de zinc cu sinteza telomerazei în celulele canceroase, determinând răspândirea tumorilor pe tot corpul [5] .
Zinc în alimente
Alimentele care conțin zinc sunt multe, printre care: stridii, carne roșie și albă, arahide, fasole, pâine integrală, semințe de dovleac și semințe de floarea-soarelui .
Mai jos sunt enumerate câteva dintre principalele alimente cu un conținut ridicat de zinc (conținute în 100 g de alimente):
- Stridie gătită: 181,61 mg
- Stridie: 90,81 mg
- Cereale pentru micul dejun: 12,4 mg
- Germeni de grâu: 12,29 mg
- Ficatul bovin: 12,02 mg
- Semințe de mac: 10,23 mg
- Drojdie de bere proaspătă: 9,97 mg
- Ciocolată neagră amară: 9,63 mg
- Chervil uscat: 8,8 mg
- Susan : 7,75 mg
- Picior de miel, fiert: 7,69 mg
- Picior de miel, slab fiert: 7,69 mg
- Ciuperci uscate: 7,66 mg
- Cardamom : 7,47 mg
- Bran grâu: 7,27 mg
- Semințe de țelină: 6,93 mg
- Cacao amară: 6,81 mg
- Müsli : 6,8 mg
- Inima de pui: 6,59 mg
- Umăr de vițel, gătit: 6,59 mg
- Curăță de vită gătită: 6,5 mg
- Nuci de pin uscate: 6,45 mg
- Osobuco de vită : 6,41 mg
- Drojdie uscată: 6,4 mg
- Umar de miel, fiert: 6,37 mg
- Zer acru evaporat: 6,31 mg
- Cimbru uscat: 6,18 mg
- Flanc de vită gătit: 6,05 mg
- Busuioc uscat : 5,82 mg
- Agar de alge uscate : 5,8 mg
- Ficat de porc: 5,76 mg
- Umar de miel la grătar: 5,72 mg
- Semințe de muștar: 5,7 mg
- Umărul slab de miel la grătar: 5,58 mg
- Umar slab de miel prăjit: 5,44 mg
- Friptură de vită gătită: 5,35 mg
- Anason: 5,3 mg
- Pulbere de ou: 5,28 mg
- Umăr de miel fript: 5,23 mg
- Picior de miel: 5,22 mg
- Picior slab de miel: 5,22 mg
- Semințe de mărar: 5,2 mg
- Piept de vită fript: 5,1 mg
- Pecane uscate : 5,07 mg
- Friptură de vită grasă gătită: 5,04 mg
- Semințe de floarea soarelui uscate, decojite: 5 mg
Nivelurile de aport recomandate sunt:
- Copii 4-8 ani: 3-5 mg / zi
- Copii 9-13 ani: 8 mg / zi
- Bărbați: 11 mg / zi
- Femei: 8 mg / zi
- Sarcina: 11-13 mg / zi
- Alăptarea: 12-14 mg / zi.
Cuprul antagonizează zincul. Echilibrul cupru-zinc din țesuturi este important pentru a nu duce la tulburări scheletice și tulburări ortopedice: se știe că latirismul, care aparent produce un deficit de cupru, provoacă scolioză, spondiloză și cifoscolioză. Un exces relativ de zinc în comparație cu cuprul reduce legarea încrucișată a colagenului, rezultând laxitate ligamentară și instabilitate articulară. În schimb, excesul de cupru reduce efectul zincului asupra sintezei proteinelor, rezultând o deficiență a proteinelor normale.
Precauții
Zincul metalic nu este toxic, dar există un sindrom numit frisoane de zinc , care poate apărea din inhalarea oxidului de zinc nou format. Consumul excesiv de zinc din dietă poate provoca deficiențe în alte urme de minerale.
Un studiu epidemiologic amplu efectuat pe 47.000 de bărbați a constatat o creștere a cancerului de prostată pentru suplimentele de zinc, nu pentru cele dietetice, luate în doze de 100 mg / zi pentru perioade prelungite (1 până la 10 ani), mai mult proporțional cu durata aportului și doza [6] .
Doza a fost mult mai mare decât necesarul de zinc al unui adult, care este calculat ca 0,1 mg / kg / zi. Zincul stimulează hormonul de creștere IGF1 și testosteronul și în doze mari blochează rolul protector al seleniului împotriva cancerului de prostată.
La fel, zincul este un stimulent puternic pentru răspunsul imun, dar în doze mari îl slăbește.
Citate literare
- Una dintre poveștile din „ Sistemul periodic ” al lui Primo Levi este dedicată zincului.
Notă
- ^ Statistici privind producția de zinc USGS
- ^ Anuário Mineral Brasileiro
- ^ Guidausofarmaci.it .
- ^ (EN) Zincul este un imunomodulator al căii NF-kB în epitelia pulmonară umană pe atsjournals.org, Universitatea de Stat din Ohio Davis Hearth and Lung Research Institute și Ohio State University College of Pharmacy.
- ^ Modularea activității telomerazei de către zinc în celulele cancerului prostatic și renal uman , Biochem Pharmacol. 15 februarie 2000; 59 (4): 401-5
- ^ Leitzmann MF și colab. Utilizarea suplimentului de zinc și riscul de cancer de prostată , J Nat Cancer Instit 2003; 95: 1004-07, pe baza datelor de cercetare din Studiul de urmărire al profesioniștilor din domeniul sănătății
Bibliografie
- Francesco Borgese, Elementele din tabelul periodic. Descoperire, proprietăți, utilizări. Handbook chimice, fizice, geologice , Roma, CISU, 1993, ISBN 88-7975-077-1 .
- R. Barbucci, A. Sabatini și P. Dapporto, Tabel periodic și proprietăți ale elementelor , Florența, Edizioni V. Morelli, 1998 (arhivat din original la 22 octombrie 2010) .
Voci correlate
- London Metal Exchange – mercato dei metalli non ferrosi
- Economia allo zinco
- Zinco nativo
- Composti dello zinco
Altri progetti
-
 Wikizionario contiene il lemma di dizionario « zinco »
Wikizionario contiene il lemma di dizionario « zinco » -
 Wikimedia Commons contiene immagini o altri file su zinco
Wikimedia Commons contiene immagini o altri file su zinco
Collegamenti esterni
- Zinco , su Treccani.it – Enciclopedie on line , Istituto dell'Enciclopedia Italiana .
- ( EN ) Zinco , su Enciclopedia Britannica , Encyclopædia Britannica, Inc.
- ( EN ) Zinco , su periodic.lanl.gov , Los Alamos National Laboratory .
- ( EN ) Lo zinco , su WebElements.com .
- ( EN ) Lo zinco , su EnvironmentalChemistry.com .
- Lo zinco in nutrizione , su nutritionvalley.it . URL consultato il 14 gennaio 2007 (archiviato dall' url originale il 4 luglio 2007) .
- Lo zinco negli alimenti , su valori-alimenti.com .
| Controllo di autorità | Thesaurus BNCF 26599 · LCCN ( EN ) sh85149842 · GND ( DE ) 4137453-8 · BNF ( FR ) cb119731249 (data) · BNE ( ES ) XX529698 (data) · NDL ( EN , JA ) 00560063 |
|---|