Boala Chagas
Această intrare sau secțiune despre subiectul bolilor nu menționează sursele necesare sau cei prezenți sunt insuficienți . |
| Boala Chagas | |
|---|---|
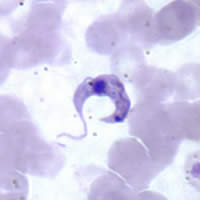
| Tripomastigot al T. cruzi în sângele periferic (Sursa: CDC ) | |
| Specialitate | boli infecțioase și parazitologie |
| Etiologie | Trypanosoma cruzi |
| Clasificare și resurse externe (EN) | |
| Plasă | D014355 |
| MedlinePlus | 001372 |
| eMedicină | 214581 |
| Sinonime | |
| Tripanosomiaza americană | |
| Eponime | |
| Carlos Chagas | |
Boala Chagas, cunoscută și sub numele de tripanosomiază americană, este o boală infecțioasă. Aparținând categoriei paraziților , prezintă forme clinice acute și forme cronice și este cauzat de protozoarul Trypanosoma cruzi . Rezervorul de paraziți este indivizii infectați cronic. Purtătorii sunt insecte hematofage de diferite genuri. [1]
Se transmite în primul rând prin intermediul insectelor cunoscute sub numele de Triatominae . [1] Simptomele se modifică pe parcursul infecției. În faza inițială, în general, acestea nu sunt prezente sau se dovedesc a fi ușoare, cum ar fi febră , umflarea ganglionilor limfatici , cefalee și umflături locale la locul injectării. [1] După 8-12 săptămâni, indivizii intră în faza cronică a bolii și în 60% -70% nu prezintă alte simptome. [2] [3] În restul de 30% -40% dezvoltă simptome suplimentare într-o perioadă cuprinsă între 10 și 30 de ani după infecția inițială, [3] incluzând mărirea ventriculilor inimii în 20% -30% din cazuri, ducând la insuficiență cardiacă . [1] La 10% dintre pacienți se poate observa și o mărire a esofagului sau a colonului . [1]
T. cruzi se răspândește în mod obișnuit în rândul oamenilor și al altor mamifere prin hematofagia de supt subfamilia de insecte Triatominae . [4] Aceste insecte sunt, de asemenea, cunoscute sub mai multe nume locale, inclusiv: vinchuca în Argentina , Bolivia , Chile și Paraguay , barbeiro ( frizer ) în Brazilia , pito în Columbia , chinche în America Centrală și chipo în Venezuela . [5] Boala poate fi transmisă și prin transfuzii de sânge , transplanturi de organe , furaje cu alimente contaminate de la dăunători și pentru transmitere verticală (de la o mamă la făt ). [1] Diagnosticul precoce al bolii este găsirea parazitului în sânge cu ajutorul microscopului . [3] Boala cronică este diagnosticată prin căutarea anticorpilor împotriva T. cruzi în sânge . [3]
Prevenirea constă în principal în eliminarea insectei și evitarea înțepăturii. [1] Alte măsuri preventive includ screeningul sângelui utilizat pentru transfuzii . [1] În 2015, un vaccin nu a fost încă dezvoltat. [1] Infecțiile timpurii sunt tratabile cu medicamente benzindazol sau cu nifurtimox . [1] Tratamentul medicamentos are ca rezultat aproape întotdeauna o vindecare, dacă este administrat devreme, dar devine din ce în ce mai puțin eficient odată cu dezvoltarea infecției. [1] Când medicamentele sunt utilizate în timpul bolilor cronice, acestea pot întârzia sau preveni dezvoltarea simptomelor inițiale. [1] Benznidazolul și nifurtimoxul pot provoca efecte secundare temporare în 40% din cazuri [1] , inclusiv tulburări ale pielii , toxice pentru creier și iritarea sistemului digestiv . [2] [6] [7]
Se estimează că, în 2015, de la 7 milioane la 8 milioane de oameni, majoritatea rezidenți în Mexic , America Centrală și America de Sud , au boala Chagas. [1] În 2006, sa estimat că această afecțiune cauzează 12.500 de decese pe an. [1] Majoritatea persoanelor cu boală aparțin unei părți sărace a populației [2] și majoritatea nu știu nici măcar că sunt infectate. [8] Mișcările populației la scară largă au sporit zonele geografice în care se poate găsi boala Chagas și multe țări, inclusiv Europa și Statele Unite . [1] Aceste zone au înregistrat o creștere a cazurilor de-a lungul anilor. [9] .
Boala a fost descrisă pentru prima dată în 1909 de Carlos Chagas , care și-a luat numele [1] și afectează peste 150 de specii de animale. [2]
Istorie
În 1907, Carlos Chagas , mare malariologo Mineiro , bacteriologică a fost trimis de către Instituto Oswaldo Cruz din Rio de Janeiro , împreună cu prietenul său și colegul Belisario Penna , un Lassance , în Minas Gerais , în apropiere de Rio São Francisco, pentru a studia o " epidemie de malarie care a afectat tabăra muncitorilor care construiau calea ferată în compania EF Central do Brasil. Chagas a amenajat apoi un laborator de teren într-un vagon de tren. Localnicii i-au spus despre existența unora dintre acești bug-uri, barbeiros, care în noaptea aceea au ieșit din crăpăturile din pereții caselor și s-au urcat pe fețele locuitorilor pentru a suge sânge. A prins niște roșii și negri (ca Panstrongylus ) și a găsit, în intestinele și fecalele acestor hemiptere , mulți protozoari cu caracteristici morfologice ale tripanosomilor . La început, el a crezut o etapă evolutivă a unei insecte protozoare emoflagellato sau a altor vertebrate .
Mai târziu, s-a întors la Rio de Janeiro și a avut câteva maimuțe înțepate de insectele pe care le adunase și apoi a găsit tripanosomi în sângele periferic al uneia dintre ele. El a numit parazitul Schizotrypanum cruzi și Trypanosoma cruzi , în onoarea profesorului său Oswaldo Cruz . El a descoperit, de asemenea, formele tisulare ale parazitului, amastigotele , care s-au despărțit pentru fisiunea binară și au format cuiburi și pseudochist în mușchi și fibre cardiace. Un Lassance Chagas a raportat mai târziu primul caz de formă acută a unei noi boli: a găsit același parazit care se găsise în sângele unui copil cu febră, anemie , hepatosplenomegalie (atunci această fetiță a trăit până la vârsta matură fără probleme) . El a dovedit că acel parazit era cauza unei boli foarte frecvente în regiunile rurale ale Braziliei: tripanosomiaza americană.
În aprilie 1909, la vârsta de 29 de ani, Chagas a semnalat Revista Brasil Médico - existența unei noi entități morbide la om: tripanosomiaza americană care a devenit cunoscută sub numele de boala Chagas. A fost singurul caz din istoria medicinei în care un cercetător a descris o boală infecțioasă complet nouă, agentul său cauzal , purtătorul , gazda definitivă, tabloul clinic și „ epidemiologia ”.
Tânărul patolog paraense Gaspar Vianna a scris prima lucrare fundamentală despre patogeneza tripanosomiazei americane. În 1911 a arătat cum forma infecțioasă a Trypanosoma cruzi invadează corpul vertebratelor, pătrunde în țesuturi, se joacă și se întoarce în sânge , unde se înmulțește. Vianna a descris, de asemenea, leziunile cauzate de boala care afectează sistemul nervos, autonom și a efectuat primele observații cu privire la responsabilitatea infarctului de daune.
În anii douăzeci ai secolului al XX-lea , radiologul și cardiologul Evandro Chagas , fiul lui Carlos Chagas, a făcut primele și cele mai importante studii asupra bolilor de inimă , „Chagas” și a fost primul care a studiat semnele bolii electrocardiografice .
În 1926, Salvador Mazza și Cecilio Romaña din Argentina au dat o mare contribuție la studiul clinic al bolii și la conștientizarea guvernelor și a populațiilor din țările endemice despre problemă, astfel încât în țara lor boala este boala numită Chagas-Mazza. În anii cincizeci, patologul austro-brazilian Fritz Köberle a făcut descoperiri importante cu privire la patogeneza afectării sistemului nervos intrinsec al „ sistemului digestiv și” al aparatului cardiac .
Unii autori speculează că același Charles Darwin ar fi putut fi afectat de tripanosomiaza americană, rezultat al înțepăturii unei triatomine în timpul șederii sale în Argentina . Incidentul este raportat în jurnalele de călătorie HMS Beagle și a avut loc în martie 1835, lângă Mendoza . Charles Darwin era atunci tânăr și în stare generală bună, dar în 1837, la aproape un an de la întoarcerea în Anglia , a început să sufere intermitent de o formă ciudată de disconfort, care l-a făcut impropriu pentru tot restul vieții. Încercările de a examina rămășițele lui Charles Darwin cu teste moderne de amplificare a genelor ( PCR ) au fost întotdeauna împiedicate de șeful „ Abației Westminster, unde este îngropat naturalistul .
Agent etiologic
Trypanosoma cruzi provoacă o zonoză răspândită în zonele rurale din America Latină. Bărbatul este parazitat de diferite specii de Trypanosomatidae , hemoflagelate patogene protozoare asexuale și dixeni (cu doi oaspeți), care sunt transmise de insecte care suge sânge (Heteroptera sânge). Trypanosoma cruzi este singurul tripanosom uman care se transmite prin fecalele vectorului nevertebrat, spre deosebire de tripanosomii africani (responsabili de boala somnului ) și Trypanosoma rangeli (nepatogen), care sunt transmise oamenilor prin saliva „insectei”. Omul este un musafir accidental.
Hemoflagelații patogeni ai protozoarelor sunt numiți astfel deoarece posedă un flagel , care servește ca mijloc de locomoție și care le permite să se deplaseze în sânge . Acestea sunt creaturi unicelulare diploide, cu o acumulare de ADN asemănătoare unui disc, a spus kinetoplastul. Înmulțirea lor are loc prin divizare binară. Hemoflagelatele au diferite forme:
- Amastigotul lui T. cruzi este forma replicativă intracelulară (în celulele sistemului reticulo-endotelial și în fibrele musculare ) la gazda vertebrate. Are o formă sferică (cu un diametru de 2-4 µm). Când celula este plină de amastigote, aceasta se rupe și acestea devin tripomastigote și trec în sânge pentru a invada alte celule, în special fibrele musculare striate și cardiace, unde se înmulțesc cu sutele, formând cuiburi alungite longitudinal în direcția fibrei.
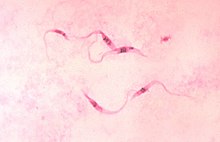
- Tripomastigotele sunt forma infecțioasă. 15-20 µm lungime și 1 µm lățime, lungă și subțire sau îndesată și curbată cu secera, cu flagelul emergând lateral cu o membrană ondulantă evidentă, care începe lângă kinetoplastul posterior nucleului. Nu se înmulțesc în sânge.
- Epimastigotul este forma reproductivă la insectă și mediul fără celule . Corp alungit, flagel emergent lateral cu o mică membrană ondulantă, care începe lângă kinetoplastul paranuclear. Forma dell'epimastigote (în jos 15-35 uM) este introdusă, de asemenea, în „ bulbul rectal insectă hematofagă are loc aici o reproducere prin fisiune binară și o parte a epimastigoti se transformă în mod regulat în trypomastigotes metaciclici, mult mai infecțioase decât sângele. Insecta rămâne un rezervor pe tot parcursul vieții sale. Ciclul din vector durează 2-4 săptămâni.
Tulpinile de T. cruzi nu sunt omogene genetic; recent au fost împărțite în două subspecii:
- T. cruzi I este asociat cu transmisia scoțiană și probabil este forma originală a T. cruzi; Nu se găsește adesea în țările sudice ale Americii de Sud și este singura formă de T. cruzi care dă boala în nordul Amazonului .
- T. cruzi II este asociat cu transmisia internă.
Ambele sunt asociate cu leziuni cardiace, dar se pare că numai T. cruzi II provoacă boli digestive.
Epidemiologie
Distribuție geografică
Se estimează că între 16 și 18 milioane de persoane sunt infectate cu T. cruzi, este endemic în 18 țări din America Latină , cu diferențe semnificative între țări.
Aproximativ 20% din populația Boliviei este infectată (aproximativ 1,2 milioane de persoane, aproximativ), în timp ce în Brazilia prevalența generală a fost de 1,3% (5 milioane de persoane), dar atinge 4% în zonele rurale.
Boala este tipică zonelor rurale sărace, cu toate acestea migrația către zonele urbane, care a avut loc în anii șaptezeci și optzeci, a schimbat modelul clasic de epidemiologie. În timp, tinde să devină o boală a zonelor urbane și periurbane degradate.
Lipsa controlului în trecut, produsele din sânge a creat o a doua cale de transmitere: între 1960 și 1989 prevalența sângelui infectat în băncile de sânge din orașele din America de Sud a variat de la 1,7% în São Paulo la 53% Santa Cruz , Bolivia, aceste procente mult mai mari decât cele ale prezenței hepatitei virale sau HIV .
În prezent, există o scădere constantă a prevalenței infestării la domiciliu de către purtători ( Triatoma infestans ) și a incidenței infecției umane la copii și tineri în țările așa-numitului con sudic ( Argentina , Uruguay , Chile ) unde acestea anul a organizat o campanie majoră de dezinfecție .
Acum problema tripanosomiazei americane îngrijorează și SUA , unde se estimează că există între 100.000 și 700.000 de imigranți din America Latină și indivizi infectați cu T. cruzi.
Pe scurt, pacientul tipic "chagasic" este:
- bărbat de origine sud-americană între 30 și 40 de ani,
- de origine rurală,
- care locuiește la periferia marilor orașe sud-americane,
- de nivel cultural scăzut,
- cine efectuează lucrări manuale,
- care vine la observarea medicului pentru seropozitivitate pentru T. cruzi, pentru examen electrocardiografic anormal (ECG) sau pentru simptome cardiace sau digestive.
Mortalitate
Boala Chagas cauzează 45.000-50.000 de decese pe an, în principal din forma cronică a inimii. O „ aritmie fatală ( VF ) este cauza morții subite cardiace în 60% din cazuri. Alte cauze sunt reprezentate de bradiaritmii , fenomene tromboembolice sau, în mod excepțional, ruperea inimii anevrismului . Insuficiența cardiacă congestivă este principala cauză de deces în 25-30% din cazuri, un „ cheag în creier sau o„ embolie pulmonară în 10-15% din cazuri. Cauzele sunt mai puțin frecvente volvulus de megacolon sigmoid dilatat, miocardită severă sau meningoencefalită acută la nou-născuți (infecții congenitale). Miocardita Acută sau meningoencefalita pot fi complicații oportuniste în cursul bolii HIV. Boala acută simptomatică apare în principal la sugarii cu infecție congenitală sau la copiii mici. Megaesofagul afectează cel mai adesea în a doua decadă a vieții, bolile cardiace cronice chagasice și megacolonul ulterior (decada III-IV-V a vieții).
Vectorul

Vectorii sunt bug-uri triatomine (de ordinul Hemiptera , subfamilii Reduviidae și Triatominae ) care au nume diferite în funcție de locație:
- Barbeiros în Brazilia
- Vinchucas în Argentina , Uruguay , Paraguay , Bolivia , Chile
- Chipos în Peru , Venezuela , Columbia
- Chinches în America Centrală și Mexic
- Sărut de gândaci în SUA
În principiu, aparțin a trei genuri:
- Triatom spp.
- Rhodnius spp.
- Panstrongylus spp.
Triatominele pot fi clasificate în funcție de caracteristicile lor comportamentale în:
- specii exclusiv domiciliare ( Triatoma infestans , Triatoma rubrofasciata , Rhodnius prolixus )
- specii în general casă și peridomiciliari care pot fi întâlnite în mediul silvanic ( Triatoma dimidiata , Panstrongylus megistus și altele)
- în special specii silvane cu incursiuni peridomiciliare (R. neglectus și altele)
- practic specii silvane, întâlnite accidental într-un mediu peridomiciliar (P. geniculatus și altele)
- specii exclusiv scoțiene ( Psammolestes spp., cavernícola spp. și altele).
Cele mai importante trei specii de vectori sunt:
Triatomul infestans este responsabil pentru mai mult de jumătate din infecțiile din sudul bazinului Amazon . Este foarte bine adaptat la mediul din casa rurală America de Sud .
Rhodnius prolixus este situat în America Centrală și la nord de bazinul Amazonului ( Venezuela și Columbia ).
Triatoma dimidiata este din Mexic în Peru , în Columbia , în Ecuador și de-a lungul coastei Pacificului .
Alte specii domestice și sălbatice sunt mai puțin importante.
Ciclul de viață al tripanosomului
Triatominele se cuibăresc în crăpăturile și interstițiile pereților caselor rustice, ale colibelor construite cu noroi și cherestea. Sunt ascunse în timpul zilei și ies noaptea să se hrănească cu sânge uman sau alte mamifere .
În timpul mesei de sânge defecați pe pielea umană (în Brazilia sunt numiți barbeiros pentru că preferă fețele oamenilor ca curtea din față). Tripomastigotii metaciclici, prezenți în fecale și în fructele de infecție contractate anterior, trec ușor prin membranele mucoase (de exemplu, conjunctiva ), sau prin pielea soluțiilor de continuitate a zgârieturilor produse în urma mâncărimii cauzate de intepatura insectelor.
În fluxul sanguin , tripomastigotele invadează celulele sistemului reticuloendotelial (macrofage), pierd flagelul și devin amastigote intracelulare. După o latență de 20-35 de ore, amastigotii încep o diviziune binară care se repetă la fiecare 12-14 ore, invadând celulele grase și musculare din apropierea locului de penetrare. Când celulele sunt saturate cu paraziți , amastigotele rup celula și se diferențiază în tripomastigote care, deplasându-se cu flagelul și membrana ondulantă sunt eliberate în circulație, libere să invadeze alte celule. Le preferă pe cele ale sistemului reticulo-endotelial, pe cele ale mușchilor striați (în special pe miocard) și pe cele ale sistemului nervos autonom și central. Aceștia pătrund în mod activ prin receptorii asemănători porinelor, revin la morfotipul amastigotului intracelular și se înmulțesc cu formarea pseudo chisturilor, provocând distrugerea elementelor celulare parazitare. Tripomastigotele nu se înmulțesc în fluxul sanguin, spre deosebire de tripanosomii africani. Tripomastigotele prezente în sânge pot fi luate de vector (atât femelele, cât și masculii sunt nimfe de sânge și triatomină) în timpul puncției. Odată ajunși în ampula rectală a insectei, aceștia sunt transformați în epimastigote metaciclice infectante care, prin fecale, ajung la noua gazdă. Infecția insectelor continuă pe tot parcursul vieții și poate fi transmisă și altor triatomine prin coprofagie și canibalism.
Metoda de transmitere
- Foto: cea mai importantă, de la triatomina, responsabilă de 80% din infecțiile cu un mecanism contaminativ, deoarece insecta este de obicei defecată în timp ce ia o masă de sânge.
- Transfuzie: 15% responsabilă de infecții, în special în orașe (riscul de infecție după ce a fost transfuzat cu sânge infectat este de aproximativ 20%).
- Vertical (materno-fetale): apare la 2-10% din cazuri de femei gravide infectate (spre deosebire de toxoplasmoza, tranziția poate avea loc în fiecare sarcină, atât în faza acută și în faza cronică a infecției), pentru via trans- placentară , aproape întotdeauna după a treia lună de gestație, în majoritatea cazurilor fără consecințe asupra sarcinii. Poate exista o formă clinică a bolii congenitale Chagas, care, fără tratament, duce la deces în 5-10% din cazuri. Transmiterea prin lapte este posibilă, dar rară.
- Mancare: rara, apare in Amazon, cu ingestia de alimente contaminate de fecalele triatominei (carnea insuficient gatita a animalelor salbatice, sucul de trestie de zahar contaminat).
- După transplant ( rinichi , inimă , măduvă osoasă ).
- Accidentale (accidente de laborator).
Rezervoare pentru animale
Numai mamiferele sunt susceptibile la infecția cu T. cruzi și sunt gazda definitivă.
- Ciclul sălbatic este menținut de la aproximativ 150 de specii de mamifere aparținând a 7 ordine diferite, inclusiv piciorul ( opossum comun ), AIS (armadillo sau bicho preguiça ), micii anteaters din genul tamandua , l ' armadillo , liliecii , pisicile sălbatice , iepuri venezueleni , multe rozătoare mici și câteva maimuțe mici. Se pare că printre rezervoarele sălbatice există și posumuri și ratoni , care se găsesc în America de Nord.
- În ciclul de acasă pot fi câini, pisici, șoareci, hamsteri și iepuri.
Porcii, ovinele, bovinele și caii au parazitemii tranzitorii și nu joacă un rol important în menținerea ciclului. Deși nu sunt infectați, puii sunt o sursă importantă de mese de sânge pentru triatomine, care sunt abundente în jurul cocoșilor de pui.
Clinica
Incubație
Boala urmează o perioadă de incubație de aproximativ o săptămână în transmiterea vectorială și în aproximativ 20-40 de zile după transmisia transfuziei, care este mai lungă, deoarece tripanosomii circulanți sunt forme mai puțin infecțioase de insecte metacicliche.
Forme acute
Formă acută clasică
Faza acută de diseminare a bolii apare în majoritatea cazurilor într-un mod inaparent sau paucisimptomatic și apare mai des la copii.
Parazitul se înmulțește în macrofage prezente la punctul de intrare și apoi se răspândește în tot corpul și limfaticele transmise de sânge, cu o perioadă de parazitemie ridicată care durează 1-2 luni.
În punctul de intrare al protozoarului apare așa-numitul chagoma, o leziune a pielii roșu-violet, foruncoloidă, edematoasă, bogată în tripanosomi în multiplicare activă în cadrul macrofagelor. Parazitul se răspândește prin limfatic local cu apariția satelitului limfadenitei .
Dacă portul de intrare este mucoasa conjunctivală, acesta are așa-numitul semn de Romaña sau ganglion limfatic oftalmologic complex , care constă dintr-un edem bipalpebral unilateral, nedureros, cu congestie și edem de pre-cască conjunctivală și limfadenită . Este prezent în 20-50% din cazuri și persistă timp de 30-60 de zile. Este posibil să aveți simultan o dacrioadenită (inflamație a glandelor lacrimale ), a spus semnul Mazza-Benitez .
Pot apărea simptome și semne ale unei boli inflamatorii sistemice tipice:
- febră
- mialgie
- limfadenopatia generalizată
- hepato-splenomegalie
- hipertermie (intermitentă, remitentă sau continuă)
- erupție eritematoasă
- insomnie
- dispnee
- tulburări gastro-intestinale (anorexie, greață, diaree)
- tulburări de respirație (bronșită)
Forma acută este rareori letală (<5% sub 2 ani): decesele au fost cel mai frecvent la sugari și la imunocompromiși care se infectează după transplantul de organe solide (o altă cale de infecție), pentru apariția unei meningoencefalite difuze sau a unei miocardite ofilind.
Boală cardiacă acută Chagas
Este o miocardită acută care este evidentă clinic în mai puțin de 5% din cazuri, de obicei în cazurile pediatrice din zonele endemice. De cele mai multe ori este ușor și reversibil. Aveți tahicardie și tulburări ale repolarizării ventriculare , tensiune scăzută a complexului QRS , ischemie subepicardică, blocuri ale atriului ventricular de diferite grade. Poate avea și alte evenimente cardiace, o consecință a unui pancardit real ( epicardită , miocardită și endocardită ), care poate evolua către insuficiență cardiacă congestivă; moartea poate apărea, de asemenea, în deplină stare de bine din cauza fibrilației ventriculare sau a tromboembolismului acut. Cele mai frecvente anomalii electrocardiografice în faza acută sunt tahicardia sinusală, alungirea segmentului PR, creșterea segmentului ST și inversarea undei T, tensiunea complexă QRS scăzută și alungirea segmentului QT (semne de miocardită acută).
Formele congenitale
Infecția intrauterină poate da avort spontan sau naște prematur. În forma acută, boala congenitală Chagas seamănă cu boala dobândită: apare la naștere sau câteva luni mai târziu. Copilul poate avea greutate mică la naștere, hepatosplenomegalie , icter , anemie , febră sau meningoencefalită cu convulsii , hipotonie musculară , hiporeflexie și tremor . Unele au chagoame metastatice hemoragice pe piele și mucoase. Au fost descrise calcificări leziuni intracraniene și oculare. Implicarea cardiacă este rară, în timp ce anomaliile gastrintestinale (megaesofag) pot provoca moartea prin aspirarea pneumoniei . Moartea apare adesea în primele săptămâni de viață și cei care supraviețuiesc suferă de sechele neurologice severe, tulburări mentale, comportamentale și dificultăți de învățare.
Formele cronice
În mai puțin de 5% din cazuri există o tranziție directă de la forma acută la o formă simptomatică cronică.
Formă nedeterminată
La forma acuta di malattia di Chagas di solito regredisce spontaneamente dopo 3-8 settimane e viene seguita da un periodo asintomatico che, nel 50-70% circa dei casi, dura tutta la vita e durante il quale il parassita sparisce dal circolo ematico o vi permane a bassissima parassitemia. Questo periodo corrisponde alla forma cronica di malattia di Chagas detta indeterminata . La guarigione definitiva spontanea è eccezionale: i pazienti restano sieropositivi, infetti e contagiosi ma non hanno alcun segno manifesto di malattia, né clinico, né elettrocardiografico, né radiologico .
La forma indeterminata è la forma cronica più comune nelle popolazioni endemiche e pone importanti problemi di salute pubblica, di diagnosi e di prognosi , poiché gli individui affetti sono asintomatici e possono condurre una vita del tutto normale, ma, pur essendo apparentemente sani, possono sviluppare forme croniche clinicamente evidenti in qualsiasi momento e, pertanto, vanno sottoposti a regolare monitoraggio clinico e strumentale. Ogni anno circa il 3% di questi pazienti sviluppa una patologia chagasica clinicamente determinata ; inoltre questi sono individui ancora contagiosi, quindi vanno indiscutibilmente esclusi dalla donazione di sangue ed emoderivati.
Una forma cronica determinata clinicamente evidente di solito si manifesta dopo 10-20 anni dall'infezione.
Cardiopatia chagasica cronica
La più comune delle forme determinate insorge nel 30% circa degli individui infetti, soprattutto maschi. È la forma con la maggiore morbidità e mortalità ed è quella che influisce più pesantemente sulla qualità della vita del paziente. Si ha un progressivo deterioramento del tessuto miocardico , con evoluzione inesorabile verso l'insufficienza di pompa, a volte anticipata dalla morte cardiaca improvvisa del paziente per l'insorgenza di un' aritmia fatale. In Brasile la cardiopatia cronica colpisce il 25-30% degli individui infetti, 1/5 dei quali (il 5% del totale) sono destinati a morirne.
L'insufficienza cardiaca congestizia, quando si manifesta, è solitamente difficile da trattare e da controllare. Prevalgono le manifestazioni congestizie (cuore destro) su quelle da insufficienza di pompa (cuore sinistro). Si hanno dispnea da sforzo, edema periferico, ascite , fegato da stasi , dolore toracico, e palpitazioni. Di solito non evolve in edema polmonare acuto. Le complicazioni più frequenti sono l'embolizzazione sistemica e polmonare e la morte cardiaca improvvisa, per aritmie fatali. Pertanto rispetto ai pazienti affetti da cardiomiopatia dilatativa di altra natura (ipertensiva, ischemica, idiopatica), quelli affetti dalla forma chagasica hanno una prognosi peggiore.
Le più comuni anomalie elettrocardiografiche nella fase cronica sono i blocchi intraventricolari (blocco di branca destra ed emiblocco anteriore sinistro), bradicardia sinusale , blocchi atrio-ventricolari di vario grado, blocco seno-atriale, fibrillazione atriale , aritmie ventricolari ( extrasistoli polimorfe, tachicardia ventricolare fino alla fibrillazione ventricolare ), conseguenze del danno al tessuto di conduzione.
Patogenesi
Durante la fase acuta della malattia si ha un'imponente moltiplicazione del tripanosoma nelle fibre muscolari cardiache , soprattutto nelle fibre del sistema di conduzione atrio-ventricolare a formare nidi di cellule amastigoti . Le alterazioni comprendono ispessimento delle pareti ventricolari, dilatazione biventricolare, aneurismi apicali e trombi murali. La patogenesi della conseguente miocardite acuta è da attribuire alla reazione cellulo-mediata nei confronti delle fibre muscolari cardiache, sia contro quelle parassitate sia contro quelle sane, contro le cellule degli endoteli capillari del miocardio e contro le fibre del sistema nervoso autonomo intracardiaco. La localizzazione degli amastigoti nel miocardio e la liberazione in questa sede di antigeni protozoari, che si legano alle cellule vicine e diventano bersaglio della risposta immunitaria umorale e cellulare contro T. cruzi , provocano una miocardite interstiziale autoimmune. L'organismo diventa incapace di controllare le risposte antiself ei danni che ne derivano sono proporzionali alla concentrazione di autoanticorpi prodotti (tachicardia, insufficienza cardiaca, che può portare all'arresto cardiaco in poche settimane o mesi dall'infezione). Incomincia anche un processo di distruzione dei gangli del SNA e, talvolta, di quello centrale, responsabile delle sindromi che si possono osservare successivamente, durante la fase cronica. La flogosi regredisce quasi del tutto quando il sistema immunitario giunge a controllare la replicazione del protozoo ea ridurne drasticamente la carica.
Nella fase di malattia cronica, anche asintomatica, persiste uno stato di minima infiammazione con foci di flogosi miocardica che poi regrediscono, ma che sono seguiti dalla comparsa di nuovi altri focolai. Si mantiene un equilibrio dinamico tra il sistema immunitario dell'ospite e il parassita, in virtuale assenza di segni e sintomi. Tuttavia persiste una miocardite diffusa con un danno progressivo, più o meno rapido, ma sostanzialmente inarrestabile, che può precipitare in qualsiasi momento in una forma clinicamente sintomatica, che evolve verso la cardiomiopatia dilatativa e l' insufficienza cardiaca .
È stato anche ipotizzato un meccanismo patogenetico di tipo autoimmune umorale con produzione di anticorpi diretti contro antigeni del tessuto cardiaco: T. cruzi condividerebbe antigeni con il miocardio. Il fatto spiegherebbe il continuo danno alle fibre muscolari del miocardio anche nella fase cronica quando i nidi di amastigoti sono pochissimi. L'entità del danno miocardico rende conto dei disturbi della conduzione atrio-ventricolare e intra-ventricolare e delle aritmie atriali e ventricolari .
Anatomia patologica
Si ha il reperto istopatologico di miocardite cronica e attiva, con necrosi microfocale e disseminata, con densi focolai di fibrosi interstiziale confluente che tende a disorganizzare la struttura delle fibre muscolari cardiache ea coinvolgere il sistema contrattile e di conduzione. Nello spazio interstiziale è presente un infiltrato cellulare infiammatorio misto di granulociti , linfociti , monociti , macrofagi , mastocellule e plasmacellule . Durante la fase cronica le cellule ganglionari del sistema di conduzione e le fibre miocardiche vengono progressivamente distrutte; la funzionalità cardiaca comincia a essere compromessa quando il 20% circa dei neuroni vengono distrutti, mentre la funzionalità esofagea è sufficiente anche con l'80% dei neuroni non funzionanti.
Nelle fasi precoci della cardiopatia cronica, il cuore può essere di dimensioni normali o solo lievemente aumentate, ma successivamente si può raggiungere una notevole cardiomegalia. Macroscopicamente il cuore chagasico cronico è ipotonico con pareti assottigliate, soprattutto a livello dell' atrio destro . In più della metà dei casi si forma un aneurisma del segmento apicale del ventricolo sinistro (aneurisma vorticoso della punta), oppure del setto interventricolare , che raramente si rompe: è un reperto patognomonico e un segno prognostico sfavorevole di malattia di Chagas nelle zone endemiche. Non è responsabile dell'insorgenza dell'insufficienza ventricolare, ma può provocare aritmie e fenomeni tromboembolici anche fatali. Si formano trombi murali nelle camere cardiache soprattutto in presenza di fibrillazione atriale e si possono avere embolie cerebrali, spleniche, renali , e polmonari .
Malattia chagasica digestiva cronica
Il 10% circa dei pazienti chagasici sviluppa una forma cronica digestiva, che consiste in una disfunzione motoria che può coinvolgere virtualmente qualsiasi segmento del tubo digerente , ma colpisce soprattutto esofago e colon .
- Patogenesi
La forma digestiva consegue alla distruzione dei plessi nervosi intrinseci ( sottomucoso di Meissner e mioenterico di Auerbach ) del sistema autonomo del tubo digerente, con un meccanismo autoimmunitario di tipo cellulo-mediato simile a quello responsabile del danno cardiaco con conseguente denervazione e fibrosi. Si ha una discinesia del segmento denervato, con scoordinamento motorio e acalasia , per ipertonia degli sfinteri che non si rilasciano più e provocano dilatazioni, allungamento e ipertrofia dei visceri a monte, soprattutto nei segmenti dove si sviluppano le pressioni maggiori e nei quali il contenuto è più solido (esofago e colon). Il transito esofageo e intestinale viene rallentato fino all'arresto.
- Megaesofago
Più spesso è colpito l'esofago (megaesofago) con disfagia , odinofagia , rigurgito , singhiozzo , tosse, dolore toracico e addominale , disturbi della deglutizione . Si possono avere complicazioni: severa malnutrizione, bronchiti irritative da aspirazione, polmoniti ab ingestis . Il 25% dei pazienti con megaesofago chagasico sviluppano un'ipertrofia delle ghiandole salivari (soprattutto le parotidi ), con scialorrea . Il decorso della malattia è tipicamente lento; si può complicare con neoplasie esofagee e gastriche.
- Megacolon
La colopatia e il megacolon sono a insorgenza più tardiva. Il sigma è il tratto più spesso colpito. Il sintomo principale è una lenta e progressiva stitichezza . La maggior parte dei pazienti con megacolon vanno di corpo una volta alla settimana circa.
- Megavisceri
Possono aversi anche megacolecisti e megacoledoco , con particolare tendenza alla colelitiasi . Il megaduodeno di solito è asintomatico, ma può provocare dispepsia , nausea e vomito, e, raramente, malnutrizione.
Malattia chagasica dell'immunodepresso
Nell' immunodepresso e nel paziente affetto dall' AIDS , la malattia di Chagas cronica si può riattivare in forma di:
- Meningoecefalite acuta diffusa.
- Lesione ascessuale encefalica , radiologicamente indistinguibile dalla neuro- toxoplasmosi o dal linfoma cerebrale primitivo.
- Forme flogistiche digestive.
- Miocardite acuta con ricomparsa di parassitemia.
Diagnosi
Esami bioumorali
Nella forma acuta si possono avere leucocitosi con linfocitosi relativa. La transaminasemia è spesso elevata. La rachicentesi mostra pleocitosi con una prevalenza di linfociti , aumento della protidorrachia e spesso si può incontrare il T. cruzi .
Esami microbiologici

Nelle prime 6-12 settimane (fase acuta), si possono vedere i tripomastigoti nell'esame a fresco della goccia di sangue (ingrandimento x400): si vedono i rapidi movimenti dei tripomastigoti. Al microscopio si devono valutare almeno 100 campi prima di dare per negativo l'esame. Lo striscio sottile e la goccia spessa di sangue periferico colorati ( colorazione di Giemsa ) hanno minore sensibilità, ma permettono una migliore distinzione tra T. cruzi e T. rangeli , infatti quest'ultimo è più lungo (25– 35 μm ) e ha un cinetoplasto più piccolo. L'esame del QBC dopo concentrazione con centrifugazione dopo lisi degli eritrociti o defibrinizzazione aumenta la sensibilità fino al 90-100%.
Nella fase cronica la parassitemia è bassissima, perciò gli esami emoscopici risultano quasi sempre negativi. Per confermare la diagnosi si esegue la xenodiagnosi oppure l' emocoltura . I parassiti nel sangue vanno coltivati su un terreno speciale ( liver infusion tryptose , LIT) mantenuto a 28 °C e osservato mensilmente per 4-6 mesi. Le emocolture hanno una sensibilità del 100% nella fase acuta ma solo del 20-70% nelle fasi croniche.
Xenodiagnosi
La xenodiagnosi è il miglior sistema di diagnosi parassitologica nelle fasi indeterminata e cronica. Si lascia che una quarantina di ninfe di triatomine al III-IV stadio, allevate in laboratorio e pertanto sane, chiuse in 4 scatole (10 per scatola), succhino il sangue dal braccio del paziente. Ultimamente si è adottata la xenodiagnosi artificiale: 10 mL di sangue nel paziente in un contenitore coperto da una membrana attraverso la quale viene succhiato dalle ninfe. Le feci e l'intestino delle ninfe vengono sacrificate ed esaminate 30-45-60 giorni dopo, per la ricerca dei tripomastigoti metaciclici. Il test ha una sensibilità del 50%.
Diagnosi sierologica
I test sierologici che ricercano IgM anti– T. cruzi sono attualmente di impiego limitato nella diagnosi perché non sono facilmente disponibili e non sono standardizzati. Nelle infezioni recenti, le IgM compaiono in circolo 15 giorni dopo l'infezione, con un picco dopo 17-45 giorni e persistono per anni. Le IgM prevalgono nella fase acuta. Nelle fasi indeterminata e cronica prevalgono le IgG e le IgA.
Tra gli esami disponibili, il test di fissazione del complemento (CF) di Machado-Guerreiro è considerato il più fattibile. L' immunofluorescenza indiretta (IFA) è rapida e facile da eseguire, molto sensibile e può distinguere IgM da IgG : è la più precoce nell'evidenziare la positività per IgM dopo l'infezione iniziale seguita dall' emagglutinazione diretta (DA). Questi test hanno una sensibilità superiore al 95%. Per la diagnosi delle forme congenite è stato introdotto un test di immunofluorescenza indiretta per la ricerca delle IgM.
L'Enzyme-linked immunosorbent assay ( ELISA ) è come l'IFA molto sensibile e può distinguere IgM da IgG. I test di agglutinazione sono l'emagglutinazione indiretta ( IHA ), l'emagglutinazione diretta (DA), l' agglutinazione al lattice ( Latex Agglutination , LA) e il test di flocculazione .
Un problema notevole è quello dei falsi positivi, che possono aversi in caso di leishmaniosi , malaria , sifilide , mononucleosi infettiva, tubercolosi , lebbra , connettiviti e vasculiti o in caso di infezione da T. rangeli.
È sempre consigliato l'impiego di almeno due tecniche sierologiche differenti per la conferma della diagnosi di infezione.
Biologia molecolare
Il test di ricerca del DNA dal cinetoplasto di T. cruzi con l'amplificazione mediante reazione a catena della polimerasi ( polymerase chain reaction o PCR), può evidenziare la presenza di 1 tripanosoma in 20 mL di sangue con una sensibilità del 96-100%.
Diagnosi delle forme congenite
La madre deve essere sieropositiva per T. cruzi . Deve essere reperibile il T. cruzi nel sangue del cordone ombelicale . Presenza di IgM specifiche nel siero subito dopo la nascita, o di IgG dopo 6 mesi, in assenza di trasmissione vettoriale, trasfusionale od orale.
Diagnostica per immagine
Radiologia tradizionale
La radiografia standard del torace, nella cardiopatia chagasica può evidenziare la cardiomegalia ; nei pazienti con patologia esofagea avanzata può mostrare una formazione tubulare vicino all' aorta toracica, con livello idroaereo (megaesofago).
L' esame contrastografico dell' esofago con pasto di bario mostra la dilatazione esofagea, che termina con un notevole restringimento a livello dello sfintere esofageo inferiore (lower esophageal sphincter - LES) che risulta contratto (aspetto a coda di topo ). La radioscopia mostra le contrazioni terziarie e l'accumulo del mezzo di contrasto a monte del LES.
La classificazione radiografica della patologia esofagea distingue diversi stadi:
- Stadio I: il lume esofageo è di diametro normale; il riempimento è ritardato. L'esofago può essere ipercinetico.
- Stadio II: il lume esofageo è dilatato (megaesofago) e la motilità è irregolare. Il LES è ipertonico.
- Stadio III: la dilatazione e la ritenzione somo importanti e la motilità è chiaramente ridotta.
- Stadio IV: l'esofago è chiaramente dilatato e allungato (dolicomegaesofago) e atonico.
Nella patologia colica il clisma opaco mostra la dilatazione e l'allungamento del sigma in quasi tutti i casi (dolico-megasigma), e la dilatazione del retto nell'80% dei casi.
Ecocardiografia
È una metodica utile nello studio anche precoce della cardiopatia. Evidenzia la presenza degli aneurismi ventricolari, delle trombosi intarcardiache, delle ipocinesie e delle disfunzioni ventricolari. In fase acuta possono vedersi versamenti pericardici.
Prognosi
La prognosi dipende dalla forma della malattia, dal suo stadio e dalle sue complicanze. La fase acuta è più pericolosa nei bimbi < 2 anni, quando la malattia è quasi sempre fatale nei casi di miocardite e meningoencefalite . La cardiopatia cronica clinicamente manifesta ha una prognosi scarsa e di solito la morte sopravviene entro 5 anni per scompenso cardiaco o embolia polmonare. Il blocco di branca destra è un pessimo segno nella fase acuta. La prognosi delle forme digestive è per lo più benigna.
Terapia
Terapia eziologica
Sono discussi i benefici del trattamento eziologico delle forme indeterminate o croniche. Attualmente si consiglia di trattare i bambini e tutti i pazienti con infezione che dura da meno di 10 anni. Le percentuali di guarigione in questo gruppo di pazienti raggiunge il 50-60%, mentre nei pazienti con infezione che dura da più di 10 anni le percentuali di guarigione raggiungerebbero l'8-25%. Le forme acute e congenite della malattia di Chagas si possono trattare con due farmaci antiprotozoari :
Benznidazolo
Il benznidazolo cura praticamente il 100% dei bimbi con meno di 2 anni e il 60-70% dei pazienti con infezione acuta. Gli insuccessi sono dovuti alla eventuale resistenza al benznidazolo, alla carica parassitaria, oa cause ignote. È un composto imidazolico che inibisce la sintesi degli acidi nucleici ed è più tripanocida del nifurtimox. Agisce sulle forme circolanti e su quelle intracellulari.
Dose nell'adulto: 5–10 mg/kg/die per os diviso bid per 60 giorni. Dose pediatrica: come per l'adulto.
Un follow-up a lungo termine di pazienti con malattia di Chagas cronico, trattati con benznidazolo, avrebbe rivelato una significativa riduzione nell'incidenza di anomalie elettrocardiografiche, del peggioramento clinico e dei titoli sierologici.
Il farmaco non va impiegato in gravidanza ed è relativamente controindicato nelle insufficienze epatiche e renali, nelle malattie neurologiche o ematologiche.
Gli effetti collaterali più comuni comprendono fotosensibilizzazione cutanea , cefalea , polineuriti periferiche, anoressia , nausea , calo ponderale , astenia , alterazioni ematologiche (es. neutropenia , agranulocitosi , trombocitopenia ). Alcuni autori hanno inoltre descritto potenziali effetti cancerogeni. Le reazioni cutanee ( dermatiti da ipersensibilità immediata) compaiono 5-18 giorni dopo il trattamento, a volte con edema generalizzato, febbre, linfadeniti , artralgie , e mialgie ; la terapia con corticosteroidi permette la prosecuzione del trattamento antiprotozoario. Le polineuriti periferiche (a volte irreversibili, a meccanismo ignoto) appaiono tardivamente, dopo almeno 30 giorni di trattamento.
Nifurtimox
Il nifurtimox accorcia la durata della fase acuta e riduce la mortalità della miocardite e della meningoencefalite . Interferisce con il metabolismo glucidico del tripanosoma inibendo la sintesi dell' acido piruvico . Per il nifurtimox è riportata un'efficacia del 75-90%; tuttavia in Brasile non sembra essere altrettanto efficace.
Dose nell'adulto: 8–10 mg/kg/die per os diviso tid/qid per 120 giorni Dose pediatrica: <10 anni: 15–20 mg/kg/ die per os diviso tid/qid per 90-120 giorni 11-16 anni: 12,5–15 mg/kg/ die per os diviso tid/qid per 90-120 giorni Non va impiegato in gravidanza. Gli effetti collaterali più comuni comprendono astenia, anoressia, nausea, vomito, dolore addominale. Meno comuni rash cutanei , epatiti tossiche, disturbi neurologici centrali e periferici (es. perdita di memoria, tremori, insonnia, disorientamento, polineuriti, parestesie, convulsioni). Può aversi emolisi nei pazienti con deficienza di glucosio 6-fosfato-deidrogenasi ( favismo ). I bambini tollerano il farmaco meglio degli adulti. Nifurtimox e l' alfa-interferone ricombinante sono stati impiegati con successo in bambini infettati con trasfusioni e in tecnici di laboratorio infettati accidentalmente. L'alfa-interferone potrebbe migliorare l'attivazione dei macrofagi che uccidono il protozoo.
Antifungini
Il ketoconazolo (400 mg/die per 70 giorni) sembra essere efficace nella cura delle riattivazioni della malattia negli immunodepressi. In questi casi sono stati impiegati anche l' itraconazolo (400 mg/die) e il fluconazolo (400 mg/die).
Monitoraggio terapeutico
La terapia in fase acuta ottiene quasi immediatamente la soppressione della parassitemia. La guarigione parassitologica è quasi impossibile da accertare: alcuni autori richiedono una completa negativizzazione parassitologica e sierologica, altri ammettono bassissimi titoli sierologici e puntano alla guarigione clinica, valutabile con esame obiettivo, ECG e diagnostica per immagini.
Infezione accidentale
Il personale di laboratorio che lavora con T. cruzi e si punge con aghi infetti, ingerisce materiale infetto o ha un contatto attraverso lesioni cutanee o mucose, è da considerare potenzialmente infetto. In questi casi si eseguono test sierologici e si inizia il trattamento per 10-15 giorni, ripetendo le sierologie 15, 30, e 60 giorni dopo l'incidente.
Terapia cardiologica
Le aritmie si controllano con farmaci antiaritmici. Le bradiaritmie e la fibrillazione atriale con bassa risposta ventricolare possono richiedere un pacemaker permanente se sono sintomatiche. Nel trattamento dello scompenso cardiaco sembrano non essere ben tollerati la digitale ei farmaci vasoattivi, che vanno somministrati con cautela. I diuretici sono più efficaci. Il trapianto di cuore è controindicato perché l' immunosoppressione iatrogena riattiverebbe l'infezione. Fenomeni embolici e trombotici richiedono una terapia anticoagulante.
Terapia gastroenterologica
La terapia della malattia esofagea è la stessa dell' acalasia idiopatica . Lo scopo è di facilitare il transito di cibo e liquidi attraverso il LES acalasico . Dieta ristretta a cibi soffici o terapia con anticolinergici sono di scarsa utilità. Nifedipina o isosorbide dinitrato sublinguale preso prima dei pasti può dare sollievo nei pazienti con esofago non dilatato. La maggior parte dei pazienti con megaesofago sintomatico hanno beneficio dalla dilatazione meccanica del LES . Si hanno recidive nel 26% dei pazienti, che possono essere di nuovo trattati con altre dilatazioni. La terapia chirurgica è riservata per i casi più gravi, quando la dilatazione meccanica non ha più effetto e consiste in una esofago-cardiomiotomia secondo Thal , a livello della giunzione gastroesofagea anteriore, seguita da valvuloplastica per il controllo del reflusso gastrico.
I pazienti nelle prime fasi della malattia colica possono essere controllati con diete ricche di fibre e liquidi o con lassativi, occasionalmente con clisteri . L'ingombro fecale può richiedere la disostruzione manuale. I fecalomi si trattano con clisteri e lavaggi. Nei casi più gravi è necessario lo svuotamento manuale in anestesia generale. Lo svuotamento endoscopico si può fare nei pazienti che non abbiano segni di ischemia intestinale. I casi più gravi richiedono l'intervento chirurgico (es. frequente ingombro fecale, volvolo del sigma ), che consiste nella resezione del sigma o di parte del retto (necessaria per prevenire recidive di megacolon nella porzione anastomizzata con il retto).
Profilassi
Non esiste vaccino attualmente impiegabile su larga scala e non si fa chemioprofilassi (tossicità farmacologica).
Profilassi ambientale
Disinfestazione domiciliare e peridomiciliare dalle triatomine, con insetticidi piretroidi o benzene esacloride . Chiudere le crepe nelle pareti e controllare porte e finestre delle case rurali, per limitare la penetrazione delle triatomine. Miglioramento delle condizioni socio-economiche delle popolazioni a rischio.
Profilassi su donatori e sugli emoderivati
Controllo dei donatori di sangue nelle aree endemiche con test sierologici. Trattamento del sangue e degli emoderivati con il violetto di genziana : 250 mg/L di sangue, diluito 1:4000 per 24 ore a 4 °C).
Profilassi negli immunodepressi
La chemioprofilassi secondaria può essere consigliata, per prevenire la riattivazione delle forme croniche, nei pazienti chagasici co-infettati con HIV o in terapia immunosuppressiva ( leucemia , linfomi , neoplasie solide, trapianti) o corticosteroidea . In tal caso si impiega il benznidazole a 5 mg/kg/die 3 volte/settimana. È stata proposta anche una profilassi a lungo termine nei pazienti che rispondono alla terapia della riattivazione di malattia, ma la questione è ancora discussa.
Note
- ^ a b c d e f g h i j k l m n o p q Chagas disease (American trypanosomiasis) Fact sheet N°340 , su World Health Organization , March 2013. URL consultato il 23 febbraio 2014 .
- ^ a b c d Rassi A, Rassi A, Marin-Neto JA, Chagas disease , in Lancet , vol. 375, n. 9723, April 2010, pp. 1388-402, DOI : 10.1016/S0140-6736(10)60061-X , PMID 20399979 .
- ^ a b c d Rassi A Jr, Rassi A, Marcondes de Rezende J, American trypanosomiasis (Chagas disease) , in Infectious disease clinics of North America , vol. 26, n. 2, June 2012, pp. 275-91, DOI : 10.1016/j.idc.2012.03.002 , PMID 22632639 .
- ^ DPDx – Trypanosomiasis, American. Fact Sheet , su cdc.gov , Centers for Disease Control (CDC). URL consultato il 12 maggio 2010 .
- ^ Maudlin I, Holmes PH, Miles MA (a cura di), The Trypanosomiases , Wallingford, CAB International, 2004, p. 184 , ISBN 978-0-85199-034-7 .
- ^ Bern C, Montgomery SP, Herwaldt BL, etal, Evaluation and treatment of chagas disease in the United States: a systematic review , in JAMA , vol. 298, n. 18, November 2007, pp. 2171-81, DOI : 10.1001/jama.298.18.2171 , PMID 18000201 .
- ^ Rassi A, Dias JC, Marin-Neto JA, Rassi A, Challenges and opportunities for primary, secondary, and tertiary prevention of Chagas' disease , in Heart , vol. 95, n. 7, April 2009, pp. 524-34, DOI : 10.1136/hrt.2008.159624 , PMID 19131444 .
- ^ Capinera JL (a cura di), Encyclopedia of entomology , 2nd, Dordrecht, Springer, 2008, p. 824 , ISBN 978-1-4020-6242-1 .
- ^ Bonney KM,Chagas disease in the 21st Century: a public health success or an emerging threat? , in Parasite , vol. 21, 2014, p. 11, DOI : 10.1051/parasite/2014012 , PMC 3952655 , PMID 24626257 .
Bibliografia
- Adler D. Darwin's illness. Isr J Med Sci. 1989 Apr;25(4):218-21. ( Abstract )
- Kirchhoff, LV. American Trypanosomiasis (Chagas' Disease) -- A Tropical Disease Now in the United States. N Engl J Med. 329 (9):639-644, August 26, 1993 ( Abstract )
- Hofflin JM, et al. Laboratory-acquired Chagas disease. Trans R Soc Trop Med Hyg. 1987;81:437-40.
- Coutinho M. Ninety years of Chagas disease: a success story at the periphery. Soc Stud Sci. 1999 Aug;29(4):519-49. Medline abstract
- Dias JC, Silveira AC, Schofield CJ. The impact of Chagas disease control in Latin America: a review. Mem Inst Oswaldo Cruz. 2002 Jul;97(5):603-12 Full text
- Moncayo A. Progress towards Interruption of Transmission of Chagas Disease, 1999, Mem Inst Oswaldo Cruz. 1999; 94(Sup I) 401-404.
- Prata A. Evolution of the clinical and epidemiological knowledge about Chagas disease 90 years after its discovery. Mem Inst Oswaldo Cruz. 1999;94 Suppl 1:81-8. Medline abstract
- Simposio Internazionale per il 90º anniversario della scoperta della malattia di Chagas (Rio de Janeiro, 11-16 aprile, 1999) in Memórias do Instituto Oswaldo Cruz , Vol. 94, Suppl. I, 1999
( Indice del volume , con articoli integrali disponibili in formato PDF)
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su malattia di Chagas
Wikimedia Commons contiene immagini o altri file su malattia di Chagas
Collegamenti esterni
- Chagas: the disease . World Health Organization.
- American Trypanosomyasis . CDC Disease Information (US Federal Government public domain).
- Chagas Disease . PanAmerican Health Organization.
- Chagas disease . The UNDP-UNICEF-WHO-World Bank Special Programme of Research (TDR).
- Chagas disease . Medline Plus.
- Disease Information. American Trypanosomiasis or Chagas Disease . Travel Medicine Program. Health Canada.
- Chagas Disease (American Trypanosomiasis . eMedicine.
- Chagas Control in the Southern Cone Countries: History of an International Initiative, 1991/2001 , PAHO. ( Full text e-book )
- Tropical Medicine Central Resource USUHS [1]
| Controllo di autorità | LCCN ( EN ) sh85022320 · NDL ( EN , JA ) 00561175 |
|---|