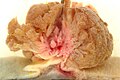
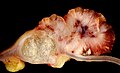
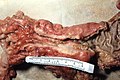
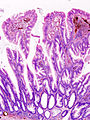
Cancer colorectal
| Cancer colorectal | |
|---|---|
 Amplasarea și forma de cancer de colon si rectal | |
| Tip | > 98% maligne <2% benigne |
| Celula de origine | Epiteliul de colon |
| Factori de risc | Fum Un aport excesiv de carne rosie Excesul de calorii Scăzut de fibre de consum Lipsa activității fizice |
| Incidenţă | 40-60 / 100.000 |
| Vârsta medie la diagnostic | 60 - 79 ani |
| Raportul F: M | 1.2: 1 |
| Clasificare și resurse externe | |
| ICD - 9 -CM | (RO) 153,0 - de 154,1 |
| ICD - 10 | (RO) C18 - C20 |
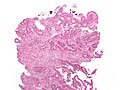
 Sectiunea histologică a adenocarcinom de colon | |
Cancerul colorectal (CRC [1] ) este cel mai frecvent maligne tumora originare din colon , rect si apendice . Cu 610,000 de decese pe an la nivel mondial, aceasta este a treia forma cea mai comuna de cancer [2] .
Aceasta este cauzată de creșterea anormală a celulelor , cu capacitatea de a invada tesuturile si raspandirea in alte parti ale corpului. [3] Semnele si simptomele pot include: oculte de sânge în scaun , schimbarea tranzitului intestinal , pierderea în greutate și senzație de oboseală. [4] Cele mai multe tipuri de cancer colorectal sunt datorate stilului de viață și a vârstei avansate și doar câteva cazuri sunt atribuite moștenite boli genetice . [5] [6] Factorii de risc includ: dieta , obezitatea , fumatul , alcoolul si redus activitatea fizica . [5] [6] Un alt factor de risc este cronică inflamatorie intestinală boală incluzând boala Crohn și colita ulceroasă . [5]
Unele dintre condițiile moștenite care pot cauza cancerul colorectal includ polipoză adenomatoasă familială și ereditar non-polipoza cancer colorectal ; Cu toate acestea, aceste condiții reprezintă mai puțin de 5% din cazuri. [5] [6] Cancerul colorectal pot fi diagnosticate prin biopsie obținute în timpul unei sigmoidoscopie sau colonoscopie . [4] Aceasta este apoi urmată de obicei de imagistica teste pentru a determina daca boala are răspândire. [7] Screening - ul este eficient in reducerea riscului de deces din acest cancer si este recomandata intre 50 si 75 intre. [8]
Tratamentul pentru cazurile de cancer colorectal poate include o combinatie de chirurgie , radioterapie , chimioterapie, și terapie vizate . [7] Cancerele care se limitează la interiorul peretelui colonului poate fi curabile cu o intervenție chirurgicală, în timp ce în cazul în care acesta sa răspândit și este , de obicei , nu se poate întări și , prin urmare , o încercare de a îmbunătăți calitatea vieții și a simptomelor este ales. [7] In Statele Unite , ratele de supravietuire la 5 ani sunt de aproximativ 65%. [9] Acest lucru, cu toate acestea, depinde de punerea în scenă a tumorii si starea generala de sanatate a persoanei. [4] Cancerul colorectal este al treilea cel mai frecvent tip de cancer la nivel mondial și reprezintă aproximativ 10% din toate cazurile de cancer. [10] În 2012, au fost înregistrate 1,4 milioane de cazuri noi și 694 000 de decese. [10] Este mai frecventa in tarile dezvoltate, unde se găsesc peste 65% din cazuri, [5] și este mai puțin frecventă la femei decât la bărbați. [5]
Epidemiologie

nu există date
mai mic de 2,5
2,5-5
5-7,5
7.5-10
10-12.5
12.5-15
15-17.5
17.5-20
20-22.5
22.5-25
25-27.5
mai mult de 27,5
Cancerul de colon pe locul doi pentru a mortalitatii de cancer la bărbați și la femei treia [12] [13] . Este cel mai frecvent in America de Nord, Europa de Vest și Noua Zeelandă . În Italia , există 40 de cazuri noi la 100 000 de locuitori, dintre care cea mai mare incidență este între deceniul al cincilea și al șaptelea. In timp ce cancerul de colon afecteaza ambele sexe in mod egal, cancerul rectal are un bărbat: femeie raport de aproximativ 2: 1 [14] . În ultimele două decenii, a existat o creștere progresivă în debutul CRC; Cu toate acestea, datorită mai devreme de diagnostic si evolutia terapii , de cinci ani de supravietuire a crescut semnificativ [13] . Site - urile cele mai afectate sunt rect (39%) și sigma (25%), însă fără a cruța nici un district colorectal.
Cauze
Genetica
Celulele acestei tumori , de obicei , au moștenit sau dobândit mutații pe durata de viata in genele implicate in Wnt cale de semnalizare și / sau replicarea ADN - ului [15] sau și / sau repararea ADN - ului [16] .
Factori de risc și condiții
Unii factori care influențează riscul de apariție a acestei boli sunt:
- Vârstă: Incidența CRC crește odată cu vârsta subiectului. Aceasta afecteaza rar persoanele sub vârsta de 50 de ani. Cazurile de CRC la adulți tineri sunt asociate cu predispozante condițiile familiale (a se vedea mai jos).
- Prezența colon polipi . Această afirmație este mângâiat de următoarele dovezi:
- In polipi izolate, zone de tumori maligne dovedite pot fi prezente. In schimb, in leziunile localizate de cancer colorectal sunt adesea adenomatoși zone care pot fi atribuite formațiunilor polypoid anterioare [17] .
- Site-ul de debut de polipi este de multe ori site-ul de debut al CRC.
- Subiecții cu polipi sunt mai susceptibile de a dezvolta CRC decât subiecții sănătoși [18] .
- Cu cat mai multe polipi diagnosticat in persoana, cu atat mai mare probabilitatea de a dezvolta CRC.
- Polipectomia reduce apariția CRC.
- Adenoame multiple sincrone și sunt adesea găsite în timpul CRC o intervenție chirurgicală .
- Familiaritate.
- Prezența rude grad 1 si 2 cu polipoză familială adenomatoasă (FAP) crește riscul de a contracta CRC.
- Prezența rudelor grad 1 si 2 cu cancer colorectal ereditar non-polipoza (HNPCC) crește riscul de a contracta CRC [19] .
- Fum. Fumătorii sunt mai susceptibile de a muri de la CRC decat nefumatorii. Un studiu realizat de Societatea Americana de Cancer rapoarte ca „femeile care fumeaza sunt mult mai probabil (40%) de a muri de la CRC decat femeile care nu fumeaza. In mod similar, barbatii care fumeaza sunt mult mai probabil (30%) de a muri de la CRC decât bărbații care au sunt nefumători. " [20] .
- Dietă. Conținutul ridicat de grăsimi și proteine din dieta crește apariția CRC [21] , în raport cu puterea cancerigenă a proteinei catabolites și a colesterolului . Alte studii confirmă importanța de fibre și fructe de consum ca factor de protecție [22] . În special, fructe vitamine și antioxidanți , cum ar fi vitamina C , acid folic, metionină, calciu si vitamina D, care poate reduce riscul de cancer colorectal. Contribuția suplimentară a sănătății digestive este furnizat de acizi grași cu lanț scurt [23] .
- Factori de mediu. Persoanele care locuiesc în zonele industrializate au un risc mai mare de a dezvolta CRC [12] [18] .
- Prezența cronice proceselor inflamatorii ale intestinului , cum ar fi boala lui Crohn și colita ulceroasă [24] [25] . Aproximativ 1% dintre pacienții CRC au antecedente de colita ulcerativa . Riscul de a dezvolta CRC este conectat direct cu severitatea deteriorarea intestinale mucoasei și cu amploarea procesului inflamator. Riscul de a dezvolta CRC la subiectii cu boala Crohn este mai mică decât la subiecții cu colita ulcerativa [26] .
- Hormonii . Diferențele în incidența și vârsta de debut între bărbați și femei pot fi atribuite structurii hormonale diferite între cele două sexe; în special, accentul a fost pus pe estrogen [27] . Prezența date contradictorii face ca aceste studii încă fiabile [28] . De fapt, o creștere în debutul CRC a fost raportată la femeile care urmează tratament de substituție cu estrogen [29] , care rezultă în contrast cu rolul protector ipotetic de hormoni feminini.
Anatomie patologică
aspect macroscopic
Cancer colorectal pot apărea în forma vegetativă (pătrunde în interiorul canalului intestinal, cum ar fi polipi), ulcerat (frecvente), infiltrarea mucoasei (margini clare și prost ridicate, rare) și circulară stenozantă (ca un inel în jurul mucoasei intestinale). În general, tumorile colonului drept au cel mai adesea o morfologie vegetativă; datorită calibru mai mare a intestinului la acest nivel, ele stenotiate lumenul cauzând obstrucție intestinală numai în etapele ulterioare (cu excepția cazului în care sunt localizate la valva ileocecală); Cu toate acestea, în ciuda debutul simptomelor mai târziu, ele tind să se infiltreze în perete mai devreme de colon stâng. Neoplasmul de colon stâng, pe de altă parte, arată semne de ei înșiși mai devreme (în general, obstrucție a intestinale), dar acestea tind să se infiltreze în peretele intestinului, cu mai puțin de viteză.
- aspect macroscopic
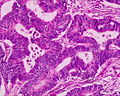
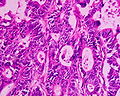
Aspect microscopic
[30] Clasificarea histologică propusă de OMS (PDF), la whqlibdoc.who.int. Adus de 16 ianuarie 2009 (arhivate de original pe 26 ianuarie 2009). </ Ref>. Cel mai comun tip este adenocarcinomul (95%) [31] , dar următoarele sunt de asemenea recunoscute:
- Tumorile epiteliale: adenocarcinom mucinos , signet adenocarcinom inel de celule , carcinom scuamos , adenovirusurilor scuamoase carcinom, carcinom nediferențiat
- Carcinoids : cu argint-afină sau celule non-argint-afină, dar , de asemenea , compozit
- Non-epiteliale tumori: leiomyosarcomas și sarcoamele
- Cancerul de colon cu vindecare Wall Fat extern : Tumora predominant maligne este acoperit cu o masă de grăsime, acest lucru duce la pacient ca urmare a unei controlate de dieta carbohidrati . Masa de grăsime protejează organismul de expansiunea masei tumorale interne. Cele mai multe metode comune (în ultimii ani, acestea sunt evitate, datorită efectelor periculoase în post-operație) asigură îndepărtarea totală a masei cu tumora in interiorul acestuia, însă acest lucru a dus la o expansiune corporală a tumorii maligne la variați pacienți , conducându (fără acoperire exterioară) la un caz de terminal. Cele mai multe metode inovatoare de tratament includ o răzuire a masei până la o îndepărtare sănătoasă prin cavitatea orală. Acest nou sistem absolut nu prevede revenirea masei tumorale.
- Aspect microscopic
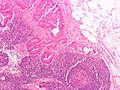
formațiuni polypoid
Un polip se poate dezvolta din mucoasa sănătoasă , în aproximativ cinci ani; cu toate acestea, este nevoie de aproximativ doi ani pentru leziunea polypoid pentru a dezvolta in carcinom in situ . Este nevoie de încă trei ani pentru a dezvolta cancer invaziv. Există mai multe histotypes: adenom tubular (75%), adenom tubulo vilos (5%) și adenomul vilos (20%). Importanța polipilor este justificată de capacitatea de transformare neoplazică în raport cu unele dintre proprietățile lor [32] :
- Morfologie. polipi sesili (baza largă de implantare) au o capacitate mai mare decât transformarea polipi pedunculați.
- Histotype. De villos adenom evoluează histotype la carcinom mai frecvent decât adenom tubular .
- Diametru. Polipii cu un diametru mai mare de 2 cm evolueze mai frecvent CSI decât cele de dimensiuni mai mici.
- Site-ul. Polipii situate proximally ( colonului ascendent si flexie hepato colic) evoluează mai frecvent spre CSI decât cele localizate distală.
- Număr. Cu cât numărul de polipi, cu atat mai mare riscul de a dezvolta CSI .
Patogenie
Spectacole cu cancer colorectal un exemplu clasic de patogeneza multipas [12] ; acest lucru înseamnă că , în scopul de a acumula mutațiile necesare pentru geneza carcinomului invaziv, sunt necesare mai multe etape, înțeleasă ca momente patologice caracterizate prin dobândirea funcției unui proto-oncogena sau prin pierderea funcției unei gene supresoare tumorale . Mutațiile genetice responsabile pentru cancer sporadice ( care nu sunt legate de mutatii dobândite genetic) a colorectale sunt aceleași care caracterizează formele ereditare [33] ; două căi patogenice majore pot fi luate în considerare [34] :
APC / β-catenin cale
Responsabil pentru 85% din CRC sporadice [30] . Paradigma este reprezentat de genetica polipoză familială adenomatoasă sindrom, ceea ce reprezintă o boală particulară în care subiectul moștenește o copie deja a suferit mutatii a genei APC ; această condiție configurează un statut foarte ridicat de risc pentru geneza cancerului colorectal la subiecții tineri. Acest fenomen este în conformitate cu conceptul de prima lovitură formulat de Knudson în 1970 [35] , care afirmă că un subiect care moștenește o alelă mutantă a unei gene supresoare tumorale este mai predispus la dezvoltarea unei tumori , deoarece o singură mutație este necesare și nu două (așa cum se întâmplă în cazuri sporadice) pentru ca produsul genetic să își înceteze activitatea.
În cazul în care CRC nu este legată de un complex sindromice genetic anterior (CRC sporadice), APC este mutantă în 80% din cazuri; nu numai că, tumorile sporadice fără implicarea APC, mutațiile actuale ale β-catenin , o proteină aparținând transductie complexelor și adeziune și strict modulate de APC. APC este o proteină de transfer, adică, o proteină capabilă să traverseze nucleare membrana prin segmente de proteine de localizare celulară; când APC se găsește în citoplasmă se leaga o serie de proteine , inclusiv Axin , GSK-3β și β-cateninei ; prin acest complex, β-cateninei este fosforilat , ubiquitinated și destinate prin descompunere a proteazomului [34] .
În cazul în care complexul APC nu funcționau, ar exista o acumulare de β-cateninei, capabil de agregare și translocate în nucleu, activând transcrierea myc genei și ciclina D1 și promovarea proliferării celulare . Nu numai; β-cateninei joacă un rol important în stabilizarea joncțiunilor intercelulare și inhibiției de contact [30] . Activarea sau inhibarea căii APC / β-catenin depinde în principal de legarea Wnt la receptorul său carliontat pe membrana plasmatică. Când Wnt este prezent, detaseaza β-catenin din APC-Axin complexe, translocă nucleul și transcrie gene specifice care promovează proliferarea, dacă în loc Wnt nu prezintă aceleași complexe induce degradarea β-cateninei prin proteazom.
Starea OFF
In starea de oprire, adică în absența Wnt, semnalizarea în aval de receptorii carliontat este inhibată de un SFRP (secretate carliontat-legate de proteine) , care aparțin unei clase de proteine antagonist Wnt și prin WIF1 (Wnt factor inhibitor 1), în timp ce un al doilea receptor esențial pentru semnalizarea aceasta cale, LRP (Lipoprotein legate de proteine receptor) este inhibată de unul dintre cele patru DKKs cunoscute (dickkopf) la om.
Asociat cu carliontat este întotdeauna fosfoproteina DVL (vâlvoi). β-catenina este găsit sau legat la complexele de adeziune cu membrană, constând din E-caderină, unde este atașat la α-catenin și p120 sau liber în citoplasmă și asociată cu o proteină formată Axin complex (la care PP2A este asociat), APC , GSK3p și WTX. Protein kinaza GSK3P și CK1 repetat fosforilat β-cateninei care pierde afinitate pentru complexul de proteine la care a fost legat, este apoi polyubiquitinated de TrCP și trimise de degradare în proteazom.
ON stat
Dacă Wnt este prezent leaga-l la receptorul său carliontat, încă o dată legat la vâlvoi. Wnt activeaza LRP, care este asociat cu proteina complex format prin APC, Axin, GSK3p, CK1 și β-cateninei, care este inhibată prin legarea Wnt cu carliontat, deci β-catenin detaseaza si migreaza spre nucleu unde este asociat factorii de transcriere TCF și Prop1 precum și la alte cofactori (CBP, Pygo, BCL9 si CDK8) prin transcriind gene care codifică proteine care promovează proliferarea celulară , cum ar fi myc și ciclină D precum și pentru proteine de adeziune , cum ar fi CD44.
Prin urmare , o mutatie a APC sau β-catenin conduce la o excesivă proliferare a epiteliului și o interacțiune celulară aberantă a celulelor.
Al doilea pas al căii APC / β-catenin este reprezentat printr - o serie de procese multistep mutagenice catalizate de proliferare epitelială intensă. Fiecare mutație implică o pierdere suplimentară a genei de control (instabilitate cromozomială [18] ), corelarea cu o posibilitate mai mare de mutații și evoluție spre fenotipului malign.
Prima genă care trebuie luat în considerare este K-Ras , oncogena mutante în peste 50% din colon carcinoamelor și responsabile pentru transducția de proliferare semnalelor. În trecut, o atenție deosebită a fost acordată rolului eliminat in cancerul de colon ( DCC) gena; cu toate acestea, experimente pe mutant soareci cu deleție a ambelor gene DCC demonstrat absența anomaliilor oncologici ulterioare. [36]
Pierderea Smad2 și în particular SMAD4 , gene care codează pentru proteine implicate în TGF-β semnalizare cale , pare să aibă un efect oncogen deosebit de important in cancerul colorectal si in alte tumori ale tractului gastrointestinal [37] . 70-80% [30] din CRCs pierdere prezent a brațului scurt al cromozomului 17 , un eveniment care implică absența P53 genei, un nod fundamental al oncosuppression ; acest fenomen pare a fi fundamental pentru invazivitatea și metastazarea capacitatea CRC, corelarea cu o mai negativ prognostic . [38]
Ca urmare a pierderii APC, o serie de mutații pot acumula care pot afecta multe gene; aceste evenimente configurează un proces în mai multe etape, cu mai multe etape, în care fiecare modificare moleculară este corelată cu o altă anatomice-patologice entitate și clinic (vezi imaginea).
Pathway de instabilitate microsatelit, MIN
Responsabil pentru 15% din CRC [30] . Paradigma este sindromul genetic al cancerului colorectal non-polipoză moștenit . Cromozomii sunt intacte. Mutația are loc in repararea asimetrie [33] , gene care codifică proteine repararea ADN - ului. Aceasta are ca rezultat o acumulare de mutatii in timpul proceselor mitotice , in special in microsatelit ADN (secvențe repetate de ADN non-codare, dar site - ul foarte important de modulare a proceselor de inducere sau arestarea transcripției [39] ).
Clinica

Site - urile cele mai afectate de CRC sunt rect și colonul sigmoid, respectiv . Inițial, simptomele pot fi nuanțate și vagi; pe de altă parte, deficit de fier anemie , din cauza sangerari cronice, pot apărea prematur. Locațiile plumb dreptul la pierderea de sânge oculte maloasa, cu astenie si pierdere in greutate; localizările de pe stânga poate în loc să se manifeste cu sângerare vizibile care rareori duce la anemie. În acest caz, cilindrul de fecale poate apărea vopsită cu sânge (hematochezie), un element ce probleme ridică în diferential diagnosticul cu hemoroizilor sangerare.
În mod similar, modificările de Alvo sunt legate de locația CRC; De fapt, în timp ce pentru locațiile de pe dreapta Alve tinde să fie tendențial diareice (deficit de absorbție), în locațiile de pe partea stângă există adesea constipație . Constipația poate fi o consecință atât a obstrucției mecanice, cât și a deteriorării structurilor nervoase cauzate de infiltrarea tumorii . In formele localizate la rect pot exista tenesmus și îngustarea dimensiunea scaunului. Ar trebui să fie întotdeauna amintit că durerea este un simptom tardiv , care mărturisește despre invazia plexurilor nervoase de tumora. Propagarea infiltrativ prin contiguitate poate duce la alterarea morfologică și funcțională a organelor din apropiere, cum ar fi vezica urinara , vagin , prostata , veziculele seminale , intestinul subțire și stomac . Limfatică diseminarea este frecventă, implicând epicolic și paracolic ganglionilor limfatici . În stadii mai avansate ale bolii acestor cartiere de noduli limfatici pot fi implicate: La nivelul rectului există trei rute principale de scurgere limfatice [41] :
- Upper limfatic districtul nod, conectat cu artera hemoroidală superioară
- Orientul Mijlociu districtul nod limfatic, conectat cu artera hemoroidală mijlocie
- Jos districtul nod limfatic, conectat cu artera hemoroidală inferioară
Sânge de diseminare joacă un rol important , deoarece, în stadiile avansate ale bolii, este adesea posibil de a urmări hepatice metastaze în virtutea strânsă portalului legătura între intestin și ficat. În unele cazuri, este posibil să se găsească metastaze în corpurile vertebrale ; această constatare este asociată cu prezența portului - Caval anastomozele capabile transportul sângelui către structurile axiale scheletului .
Simptomele sistemice pot fi febră , scădere în greutate , palpitații , paloare , cașexie și astenie . [12] [18]
Complicații

Greață , vărsături și închise gura la scaun și gaz pot fi manifestări acute obstrucție intestinală ( în special pentru localizările proximali) primari sau secundari la invaginației [42] . Abdominale distensie și efectele dăunătoare directe ale tumorii poate provoca perforații și acută hemoragie , cu acute anemie și cardiovasculare colaps. Peritonita este o complicație târzie din cauza invaziei de peritoneului ; în mod similar, invazia structurilor pelvine poate duce la formarea de abcese [28] . Bacteriene invazie fluxul sanguin este secundar mucoasă prejudiciu. Rezultată bacteriemie poate fi responsabil pentru șocul septic și foarte rapidă înrăutățire a tabloului clinic. Invazia pelvisului renal poate duce la insuficiență renală și mai mult sau mai puțin severe uremie .
Punerea în scenă
Prognosticul la persoanele cu cancer colorectal depinde strict de gradul de invazie locală a țesutului, infiltrarea organelor din apropiere, precum și prezența ganglionilor limfatici sau a altor organe metastaze .
Mai multe tipuri de stadializare sisteme pot fi utilizate, care se corelează strâns cu prognostic de profil și cinci ani de supravietuire [43] . Clasificarea Dukes, propusă de Dr. E. Cuthbert Dukes în 1932, evidențiază infiltrarea tisulară, nodul limfatic implicarea și prezența metastazelor la distanță [44] . Cu cât este mai actuală Clasificarea TNM acordă o atenție mai mare gradul de infiltrare a țesutului, discriminare între invazia mucoasei singur, a stratului muscular sau al seroasa [45] . Desi descoperirile instrumentale sunt foarte importante pentru diagnosticarea leziunilor neoplazice la distanță și implicarea ganglionilor limfatici, post-operatorie histologică evaluare este necesară pentru o evaluare corectă a montării, și , prin urmare , a prognosticului [46] .
| Ducii | Modificat Astler-Coller | Clasificarea TNM | clasificarea numerică | descriere patologica | 5 ani de supravietuire |
|---|---|---|---|---|---|
| LA | LA | T1 N0 M0 | THE | Aceasta afectează mucoasa și submucoasa | > 90% |
| LA | B1 | T2 N0 M0 | THE | Se extinde la stratul muscular | > 90% |
| B. | B2 | T3 N0 M0 | IIA | Se extinde la stratul muscular | 70-85% |
| B. | B3 | T4 N0 M0 | IIB | Ea se extinde la seroasa | 55-65% |
| C. | C1 | T1-2 N1 M0 | IIIA | Metastazele la 1-3 ganglioni limfatici regionali | 45-55% |
| C. | C2 | T3-4 N1 M0 | IIIB | 45-55% | |
| C. | C3 | Tx N2 M0 | IIIc | Metastazele la 4 sau mai multe ganglionilor limfatici regionali | 20-30% |
| D. | D. | Tx Nx M1 | IV | distant metastaze | 5% |
Mai jos este o comparație grafică a T stadializare și clasificarea Dukes.
Diagnostic și screening -

Evoluția cancerului colorectal este lent; Din acest motiv, screening - ul este un instrument important pentru devreme de diagnostic și de a organiza o mai bună terapeutice strategie. Cu toate acestea, screening - ul cancerului colorectal este încă o procedură mai puțin frecvente [47] .
În Italia , screening - ul constă în căutarea de sânge ocult în fecale (vezi mai jos). I soggetti, maschi e femmine, di età compresa tra i 50 ei 69 anni sono invitati dalla propria azienda sanitaria locale a eseguire ogni due anni, con unico campione e senza restrizioni dietetiche, il test per la ricerca del sangue occulto [48] . Se il test risulta positivo, si consiglia di eseguire ulteriori indagini ( colonscopia o clisma opaco ) per identificare la natura nel sanguinamento. Una possibile alternativa può essere rappresentata dalla colonscopia virtuale [49] , per offrire al paziente un esame con minore invasività; tuttavia con questo esame, a differenza della colonscopia tradizionale, non è possibile effettuare biopsia o rimozione di polipi e il paziente viene esposto a radiazioni ionizzanti.
Analisi ematochimiche
Oltre alla possibile anemizzazione ( Hb minore di 12 g/dL) è utile il dosaggio sierico di alcuni marcatori tumorali il CA-19.9 e il CEA (vedi oltre) [40] ; tali reperti possono essere utili soprattutto per il follow-up dopo resezione chirurgica della neoplasia.
L' antigene carcino-embrionario (CEA) è un marcatore tumorale che può essere indagato in corso di cancro del colon retto. I livelli standard di CEA sono inferiori a 5 µg/mL [50] ; livelli superiori possono essere riscontrati in corso di epatite , polmonite e gastroenterite . Inoltre, possono essere riscontrati soggetti con alti livelli di CEA senza che vi sia una patologia sottostante. Questi elementi rendono il test poco specifico per lo screening e la diagnosi di CRC; la valutazioni del CEA assumono un particolare significato nel follow-up post-operatorio: riscontrare alti livelli nei soggetti colostomizzati correla con recidiva o malattia metastatica [51] [52] .
Tuttavia, essendo tuttavia il CEA e il CA19.9, marcatori "aspecifici" e incostanti [53] [54] , negli ultimi anni è in corso la ricerca di nuovi biomarcatori che possano assumere una specificità predittiva e prognostica della malattia, nell'ottica di attuare il concetto di "medicina su misura" del paziente.
A livello italiano, ad esempio, nell'ambito della ricerca traslazionale molecolare sul tumore del retto, lo studio TiMiSNAR-mirna [55] , attivo dal 2019, ha lo scopo di analizzare e valutare i micro-RNA, come biomarcatori, che il tumore rilascia nel sangue fin dalle fasi iniziali della malattia [56] .
Sigmoidoscopia e colonscopia
Con questi esami vengono valutate le lesioni del colon , siano esse infiammatorie , polipoidi o neoplastiche maligne. Queste indagini, oltre a fornire informazioni sullo stato delle mucose e sulla morfologia delle lesioni, possono essere utili per prelevare frammenti di tessuto sospetto. [57]
Imaging biomedico
Le indagini radiologiche del colon ( clisma opaco a doppio contrasto) sono utili per indagare la sede e le dimensioni delle lesioni [58] (difficile evidenziare formazioni inferiori al centimetro). Il clisma è inoltre in grado di dare informazioni sullo stato del colon a monte ea valle della lesione (è comunque una metodica poco usata in quanto le altre tecniche, specie TC e colonscopia hanno un'efficacia diagnostica superiore e la seconda ha anche il vantaggio di essere terapeutica nei casi limitati alla mucosa).
La tomografia computerizzata e l'angioTAC possono essere utili come guida per l'intervento chirurgico [59] ; l'esame è in grado di fornire informazioni sull'invasione degli organi vicinori, sull'interessamento linfonodale e sulla presenza di metastasi epatiche . [60] In alternativa può essere usata la risonanza magnetica nucleare (RNM), più sensibile per l'indagine delle metastasi epatiche.
La PET è usata per lo studio delle piccole metastasi . [59] L'uso combinato di PET e TAC è in grado di aumentare specificità e sensibilità . [61]
L' esame ecografico è particolarmente utile per lo studio delle metastasi epatiche e per le procedure ecoguidate di biopsia delle stesse. [62]
Test di RAS
Il test di RAS è il primo test genetico che permette di determinare, al momento della diagnosi del tumore del colon retto metastatico, lo stato normale (“wild-type”) o mutato, di due geni che codificano proteine appartenenti alla famiglia RAS ( KRAS e NRAS). Il test, quindi, individua i biomarcatori oncologici che possono predire la risposta del tumore del colon retto metastatico terapia anti-tumorale con farmaci mirati anti-EGFR. Si parla di “terapia personalizzata”.
Screening : ricerca del sangue occulto nelle feci
Il test consiste nel ricercare sangue nelle feci del paziente (Hemoccult). Si possono avere falsi positivi se il soggetto presenta lesioni sanguinanti del colon [63] (ulcerazioni, colite , diverticolite ) o falsi negativi per errori tecnici del laboratorio, sanguinamento intermittente o dieta ricca di vitamina C [64] . Vengono utilizzati due tipi di test: il test chimico e immuno -chimico. La sensibilità di quest'ultimo è molto maggiore rispetto al test chimico senza che vi sia tuttavia una riduzione critica della specificità [65] .
Una delle novità più promettenti in questo campo sembra essere quella della quantificazione del DNA presente nelle feci. In questo caso non si rileva la presenza del sangue, ma si riesce a "pesare" [66] il quantitativo di DNA che è dipendente dalla maggiore esfoliazione che avviene nel cancro del colon-retto. In questo modo sembra si riducano sensibilmente i falsi negativi.
Diagnosi differenziale
Per le analoghe manifestazioni cliniche, occorre porre diagnosi differenziale con
- Emorroidi ; la presenza di feci verniciate di sangue (quindi non occulto) è suggestiva di sanguinamento emorroidario. Non va tuttavia dimenticato che la proctorragia può essere una manifestazione secondaria a CRC.
- Diverticolite e diverticolosi [67] ; il tipico dolore di queste entità cliniche è localizzato alla fossa iliaca sinistra. Tuttavia, le manifestazioni sistemiche sono molto più lievi e la colonscopia può escludere CRC.
- Malattie infiammatorie croniche dell'intestino; la malattia di Crohn e la rettocolite ulcerosa possono sostenere un quadro sistemico e locale simile al CRC. Questi soggetti vanno seguiti per escludere evoluzione verso lesioni neoplastiche [68] .
- Appendicite ; nelle localizzazioni a destra.
- Ischemie intestinali e sindrome dell'intestino irritabile [59] [69] .
- Tubercolosi intestinale [70] .
- Endometriosi .
- Presenza di corpi estranei ( fitobezoario e tricobezoario )
Trattamento
Il trattamento del tumore del colon-retto può essere indirizzato verso la cura o la palliazione. La decisione sull'obiettivo da perseguire dipende da vari fattori, tra cui la salute del paziente, le sue aspettative e la stadiazione della malattia. [71] Quando il tumore del colon-retto viene diagnosticato in tempo, la chirurgia può essere curativa. Tuttavia, quando viene rilevato in fasi successive (nelle quali sono già presenti delle metastasi), il trattamento si prefigge lo scopo di alleviare i sintomi causati dal tumore e mantenere la condizione del paziente più confortevole possibile. [72]
Chirurgia
Il trattamento chirurgico differisce in alcuni aspetti per il tumore del colon e per quello del retto. Se per le persone con un tumore localizzato del colon, il trattamento preferito è la rimozione chirurgica completa della massa con margini adeguati, al fine di perseguire una guarigione, per il tumore localmente avanzato del retto il percorso di trattamento standard prevede inizialmente una chemioradioterapia definita "neoadiuvante", ossia che va "in aiuto" al successivo trattamento chirurgico. Attualmente l'intervallo di tempo di "attesa" tra il termine della chemioterapia neoadiuvante e l'intervento chirurgico non è ancora standardizzato, per cui sono stati eseguiti e sono ancora in corso alcuni studi per valutare quale e se ci sia la tempistica migliore. In Italia, è tuttora in corso lo studio TiMiSNAR, che ha l'obiettivo di confrontare due intervalli di "attesa", 8 o 12 settimane, per eseguire l'intervento chirurgico [73] [74] . Negli ultimi 20-30 anni si è sviluppato e affermato il trattamento chirurgico mininvasivo del tumore del colon-retto, dapprima con la tecnica laparoscopica, che prevede l'accesso in addome mediante piccole incisioni sulla parete e l'utilizzo di strumentario specifico adeguato e, successivamente, con la tecnologia robotica, mediante la quale il chirurgo opera per mezzo di un "robot chirurgico". I due siti più comuni di metastasi per il tumore del colon-retto sono il fegato ei polmoni . [72]
In caso di malattia metastatica non diffusa, la cosiddetta "oligometastatica", è possibile intervenire in contemporanea, se le metastasi sono presenti nel fegato, su ambo gli organi (fegato e colon-retto), o prima o successivamente sul fegato. Tuttavia, la valutazione di intervento deve sempre essere eseguita da un tumor board, ossia un'équipe multidisciplinare composta da chirurghi specializzati nella patologia, oncologi, radioterapisti (nel caso del tumore del retto), radiologi, e gastroenterologi. In caso di metastasi polmonari è possibile eseguire un trattamento chemioterapico dopo la chirurgia sul tumore colorettale oppure una chemioterapia "adiuvante", ossia postoperatoria.
In caso di malattia metastatica diffusa o non operabile, il caso è subordinato al tumor board per le cure adeguate e specifiche.
Chemioterapia
Sia nel tumore del colon sia nel tumore del retto la chemioterapia può essere utilizzata in aggiunta alla chirurgia in alcuni casi; la decisione dipende dallo stadio della malattia.
Se il tumore è nello stadio I, viene consigliata la sola chirurgia come trattamento definitivo senza chemioterapia. Nello stadio II il ruolo della chemioterapia è controverso e solitamente non viene proposta a meno che non vi siano dei fattori di rischio come una stadiazione T4 o un inadeguato campionamento linfonodale. È noto, inoltre, che i pazienti che presentano anomalie genetiche che comportano una mancata capacità di riparazione cellulare non beneficiano di chemioterapia. Per lo stadio III e IV, invece, la chemioterapia è parte integrante del trattamento. [72]
Se il tumore si è diffuso ai linfonodi oa organi distanti, il trattamento con agenti chemioterapici quali il fluorouracile , la capecitabina e l' oxaliplatino aumenta l' aspettativa di vita . Se i linfonodi non sono stati colpiti, i benefici della chemioterapia appaiono dubbi. Se il tumore si è ampiamente diffuso o risulta non resecabile, l'unico trattamento è quello palliativo. In questo caso è possibile utilizzare diversi farmaci chemioterapici. [72] I farmaci chemioterapici per questa condizione possono includere capecitabina , fluorouracile , irinotecan e oxaliplatino . [75] La capecitabina e il fluorouracile sono intercambiabili, il primo è un farmaco somministrato per os mentre il secondo per via endovenosa . I farmaci antiangiogenici, come il bevacizumab vengono spesso aggiunti nella terapia di prima linea. Un'altra classe di farmaci utilizzati sono gli inibitori del recettore del fattore di crescita dell'epidermide , di cui i due approvati, al 2015, dalla statunitense Food and Drug Administration sono il cetuximab e il panitumumab . [76]
Radioterapia
Mentre la combinazione tra radioterapia e chemioterapia può essere utile per il tumore al retto, [72] il suo utilizzo nel tumore del colon non è di routine per via della sensibilità dei visceri alle radiazioni ionizzanti . [77] Come per la chemioterapia, la radioterapia può essere utilizzata sia come neoadiuvante sia adiuvante a seconda dello stadio della malattia.
Le cure palliative
Per cure palliative si intendono le cure mediche che si concentrano sul trattamento dei sintomi di una grave malattia, come un tumore, al fine di migliorare la qualità della vita. [78] Esse sono consigliate a qualsiasi persona in un avanzato stadio di tumore al colon o con sintomi significativi. [79]
Il ricorso alle cure palliative può essere utile per migliorare la qualità della vita, sia del paziente sia della sua famiglia, per controllare i sintomi, l' ansia e cercare di prevenire i ricoveri ospedalieri. [80]
Nelle persone con tumore colon-rettale inguaribile, le cure palliative hanno lo scopo di alleviare i sintomi o prevenire le complicanze ma non quello di curare la malattia vera e propria, con l'unico fine di migliorare la qualità della vita. Le opzioni possono includere l'approccio chirurgico non curativo per eliminare alcuni dei tessuti del tumore cancro, il bypass di una parte dell'intestino o l'impianto di uno stent . [81] I metodi non-chirurgici, invece, comprendono la radioterapia con lo scopo di ridurre le dimensioni del tumore e la prescrizione di farmaci antidolorifici. [82]
Le metastasi epatiche possono essere trattate anche mediante radioembolizzazione intrarteriosa (TARE).
Terapia adiuvante
Consiste nel trattare il paziente per evitare recidive di malattia dopo l'intervento chirurgico (vedi anche terapia adiuvante ). Non vi sono candidati i pazienti con stadio di malattia A o B1, è indicata nei pazienti in stadio C mentre non esistono indicazioni condivise per lo stadio II o B2-3.
Gli schemi possibili sono:
- 5-fluorouracile + acido folinico
- capecitabina
- schema FOLFOX ( oxaliplatino + 5-fluorouracile e acido folinico)
- schema XELOX (oxaliplatino + capecitabina)
Sono in studio terapie con farmaci di tipo mirato in associazione ai precedenti ( bevacizumab e cetuximab ) ma attualmente questi non sono inseriti negli standard terapeutici.
Specificatamente nel cancro del retto questi schemi possono essere accompagnati in vario modo alla radioterapia ; che può essere postoperatoria o preoperatoria. In ogni caso si ha una diminuzione delle recidive locali ea distanza; più marcata col secondo metodo che presenta anche un profilo di tossicità minore (non si hanno però in questo caso dati certi sull'aumento della sopravvivenza).
Chemio-radioterapia neoadiuvante
Questa viene utilizzata solo nel carcinoma del retto, e ha come obiettivi clinici quelli sotto riportati:
- riduzione dell'estensione tumorale, tale da permettere di non resecare con l'intervento chirurgico lo sfintere anale e il muscolo elevatore dell'ano.
- aumento della sopravvivenza
- diminuzione della tossicità rispetto alla terapia adiuvante
Di conseguenza viene effettuata quando:
- la malattia è in stadio avanzato (Con un T 3 o 4 o linfonodi positivi).
- i pazienti candidati all'intervento di amputazione addomino-perineale devono essere valutati per una terapia neoadiuvante atta a risparmiare lo sfintere anale.
- in pazienti in cui la chemioterapia è controindicata.
Normalmente è effettuata solo la radioterapia; in ambito di studi clinici si possono associare i chemioterapici (di solito il 5-fluorouracile + acido folinico e la capecitabina).
Follow-up
Il paziente deve essere seguito nel tempo (vedi anche follow-up ) dopo il trattamento primario per monitorare l'eventuale insorgenza di recidive o metastasi a distanza. Si consiglia:
Negli stadi II e III:
- determinazione del CEA ogni 4 mesi per 3 anni e poi ogni 6 mesi per altri 2.
- diagnostica per immagine ogni 6 mesi per 3 anni (TC torace/addome alternati a ecografia epatica e radiografia del torace).
- colonscopia: in genere si effettua una prima colonscopia pochi mesi dopo l'intervento con lo scopo principale di valutare la situazione dell'anastomosi chirurgica. In seguito la cadenza di questo esame (in assenza di polipi o altre anomalie) è ogni 3-5 anni.
Prognosi
In Europa il tasso di sopravvivenza a cinque anni per il carcinoma del colon-retto è inferiore al 60%. Nel mondo sviluppato circa un terzo delle persone colpite dalla malattia muoiono a causa di essa. [72]
La sopravvivenza è direttamente correlata alla precocità della diagnosi e al tipo di tumore, ma in generale è scarsa per i casi sintomatici, in quanto generalmente sono in uno stadio già avanzato. I tassi di sopravvivenza quando vi è una diagnosi precoce sono di circa cinque volte maggiori rispetto a quando essa viene formulata durante una fase avanzata. Le persone con un tumore che non ha violato la mucosa muscolare (TNM fase Tis, N0, M0) hanno un tasso di sopravvivenza a cinque anni del 100%, mentre quelli con tumore invasivo T1 (all'interno della sottomucosa) o T2 (all'interno della muscularis mucosae ) hanno un tasso medio di sopravvivenza a cinque anni di circa il 90%. Quelli con un tumore ancora più invasivo ma senza un coinvolgimento linfonidale (T3-4, N0, M0) hanno un tasso medio di sopravvivenza a cinque anni di circa il 70%. I pazienti con linfonodi regionali positivi (ogni T, N1-3, M0) hanno un tasso medio di sopravvivenza a cinque anni di circa il 40%, mentre quelli con metastasi a distanza (ogni T, ogni N, M1) vedono le proprie probabilità di sopravvivenza, sempre a cinque anni, a circa il 5%. [83]
Secondo statistiche effettuate nel 2006 dall' American Cancer Society , oltre il 20% delle persone con tumore del colon-retto si reca da un medico quando la malattia è già in uno stadio avanzato (stadio IV) e fino al 25% di questo gruppo presenterà metastasi isolate al fegato potenzialmente resecabili. In questo gruppo selezionato, coloro che eseguono una resezione curativa hanno dimostrato di sopravvivere a cinque anni in un terzo dei casi. [84]
Note
- ^ "CRC" sta per ColoRectal Cancer , dove cancro , tumore maligno, è un termine più generale di " carcinoma ", che si riferisce a un tumore maligno epiteliale.
- ^ Cancer Fact&Figures ( PDF ), su cancer.org , Atlanta: American Cancer Society, 2009.
- ^ Defining Cancer , su National Cancer Institute . URL consultato il 10 giugno 2014 .
- ^ a b c General Information About Colon Cancer , su NCI , 12 maggio 2014. URL consultato il 29 giugno 2014 .
- ^ a b c d e f World Cancer Report 2014 , World Health Organization, 2014, pp. Chapter 5.5, ISBN 92-832-0429-8 .
- ^ a b c Colorectal Cancer Prevention (PDQ®) , su National Cancer Institute , 27 febbraio 2014. URL consultato il 29 giugno 2014 .
- ^ a b c Colon Cancer Treatment (PDQ®) , su NCI , 12 maggio 2014. URL consultato il 29 giugno 2014 .
- ^ Screening for Colorectal Cancer , su US Preventive Services Task Force , ottobre 2008. URL consultato il 29 giugno 2014 (archiviato dall' url originale il 6 luglio 2014) .
- ^ SEER Stat Fact Sheets: Colon and Rectum Cancer , su NCI . URL consultato il 18 giugno 2014 .
- ^ a b World Cancer Report 2014 , World Health Organization, 2014, pp. Chapter 1.1, ISBN 92-832-0429-8 .
- ^ WHO Disease and injury country estimates , su World Health Organization , 2009. URL consultato l'11 novembre 2009 .
- ^ a b c d Harrison, Principi di Medicina Interna , 16ª ed., New York - Milano, McGraw-Hill, 2006, ISBN 88-386-2459-3 .
- ^ a b Sezione del sito dell'airc sul cancro del colon-retto
- ^ Scheda epidemiologica CRC di ccm-network Archiviato il 15 febbraio 2009 in Internet Archive .
- ^ Ubiquitous somatic mutations in simple repeated seque... [Nature. 1993] - PubMed - NCBI
- ^ https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2843693/?tool=pmcentrez
- ^ DeVita, Hellman, Lawrence, DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology , 8ª ed., Lippincott Williams & Wilkins, 2008, ISBN 978-0-7817-7207-5 .
- ^ a b c d Gianni Bonadonna, Gioacchino Robustelli Della Cuna, Pinuccia Valgussa, Medicina oncologica , 8ª ed., Milano, Elsevier Masson, 2007, ISBN 978-88-214-2814-2 .
- ^ HT Lynch, A. de la Chapelle. Hereditary colorectal cancer. N Engl J Med. 2003; 348: 919-932.
- ^ American Cancer Society Smoking Linked to Increased Colorectal Cancer Risk - New Study Links Smoking to Increased Colorectal Cancer Risk Archiviato il 2 dicembre 2008 in Internet Archive .
- ^ Chao A, Thun MJ, Connell CJ, McCullough ML, Jacobs EJ, Flanders WD, Rodriguez C, Sinha R, Calle EE. Meat consumption and risk of colorectal cancer. JAMA 2005;293:172-82. PMID 15644544 .
- ^ Y. Park, DJ. Hunter; D. Spiegelman; L. Bergkvist; F. Berrino; PA. van den Brandt; JE. Buring; GA. Colditz; JL. Freudenheim; CS. Fuchs; E. Giovannucci, Dietary fiber intake and risk of colorectal cancer: a pooled analysis of prospective cohort studies. , in JAMA , vol. 294, n. 22, Dec 2005, pp. 2849-57, DOI : 10.1001/jama.294.22.2849 , PMID 16352792 .
- ^ Dietary chemoprevention of colorectal cancer.Angelo Forte, Rita De Sanctis, Giovanni Leonetti, Simone Manfredelli, Vincenzo Urbano, Marcello Bezzi. Annali Italiani di Chirurgia Archiviato il 12 novembre 2014 in Internet Archive ., da sito DOC24
- ^ Gregory L. Brotzman and Russell G. Robertson, Colorectal Cancer Risk Factors , su Colorectal Cancer , Armenian Health Network, Health.am, 2006. URL consultato il 16 gennaio 2008 .
- ^ Jerome J. DeCosse, MD; George J. Tsioulias, MD; Judish S. Jacobson, MPH, Colorectal cancer: detection, treatment, and rehabilitation ( PDF ), in A Cancer Journal for Clinicians , Colorectal cancer: detection, treatment, and rehabilitation, febbraio 1994. URL consultato il 16 gennaio 2008 (archiviato dall' url originale il 26 febbraio 2008) .
- ^ Hamilton SR. Colorectal Carcinoma in patients with Crohn's Disease. Gastroenterology 1985; 89; 398-407
- ^ DO SANTOS SILVA I. ; SWERDLOW AJ, Sex differences in time trends of colorectal cancer in England and Wales: the possible effect of female hormonal factors. , in British journal of cancer , Familial relative risk of colorectal cancer: a population-based study, ISSN 0007-0920, 2007. URL consultato il 16 gennaio 2009 (archiviato dall' url originale il 13 gennaio 2009) .
- ^ a b MD Abeloff, JO Armitage, JE Niederhuber, MB Kastan, WG McKenna. Clinical Oncology 3° edition. 2004.
- ^ Beral V, Banks E, Reeves G, Appleby P. Use of HRT and the subsequent risk of cancer. Imperial Cancer Research Fund Cancer Epidemiology Unit, Oxford, UK. 1999;4(3):191-210; discussion 210-5. PMID 10695959 .
- ^ a b c d e Robbins e Cotran, Le basi patologiche delle malattie , 7ª ed., Torino - Milano, Elsevier Masson, 2008, ISBN 978-88-85675-53-7 . </ref La classificazione dell' Organizzazione mondiale della sanità (OMS) suggerisce la suddivisione in tumori epiteliali , carcinoidi , non epiteliali e del sistema emopoietico
- ^ CM Townsend Jr, RD Beauchamp, BM Evers, KL Mattox. Trattato di chirurgia. Le basi biologiche della moderna pratica chirurgica (prima edizione italiana sulla sedicesima americana). 2003: 929-973
- ^ Articolo sui polipi del colon di medicinenet
- ^ a b Ionov Y, Peinado MA, Malkhosyan S, Shibata D, Perucho M, Ubiquitous somatic mutations in simple repeated sequences reveal a new mechanism for colonic carcinogenesis , in Nature , vol. 363, n. 6429, 1993, pp. 558-61, DOI : 10.1038/363558a0 , PMID 8505985 .
- ^ a b Pontieri - Russo - Frati, Patologia generale , 3ª ed., Padova, Piccin, 2005, ISBN 88-299-1734-6 .
- ^ KudsonAG:Two genetic hits (more or less) to cancer. Nat Rev Cancer 1:157, 2001.
- ^ Bader S, Walker M, McQueen HA, Sellar R, Oei E, Wopereis S, Zhu Y, Peter A, Bird AP, Harrison DJ, MBD1, MBD2 and CGBP genes at chromosome 18q21 are infrequently mutated in human colon and lung cancers , in Oncogene , vol. 22, n. 22, 2003, pp. 3506-10, DOI : 10.1038/sj.onc.1206574 , PMID 12776203 .
- ^ Takedo MM, Takaku K: Gastro-intestinal tumorigenesis in SMAD4 mutant mice. Cytokine growth factor Rev 11:147, 2000
- ^ Kobayashi M, Watanabe H, Ajioka Y, Yoshida M, Hitomi J, Asakura H, Correlation of p53 protein expression with apoptotic incidence in colorectal neoplasia , in Virchows Arch. , vol. 427, n. 1, 1995, pp. 27-32, PMID 7551342 .
- ^ Genetica umana e medica .
- ^ a b Dionigi, Basi teoriche e Chirurgia generale - Chirurgia specialistica , 4ª ed., Padova, Elsevier Masson, 2006, ISBN 978-88-299-1654-2 .
- ^ Mazzeo - Forestieri, Trattato di chirurgia oncologica , Padova, PICCIN - Nuova libreria, 2003, ISBN 978-88-299-1654-2 .
- ^ CM Townsend Jr, RD Beauchamp, BM Evers, KL Mattox. Trattato di chirurgia. Le basi biologiche della moderna pratica chirurgica (prima edizione italiana sulla sedicesima americana). 2003
- ^ Harrison, Neoplasie maligne dell'apparato gastroenterico , in Principi di Medicina interna , 16ª ed., New York - Milano, McGraw - Hill, pp. 607-608, ISBN 978-88-386-3929-6 .
- ^ Dukes CE. The classification of cancer of the rectum. Journal of Pathological Bacteriology 1932;35:323.
- ^ Wittekind, Ch; Sobin, LH, TNM classification of malignant tumours , New York, Wiley-Liss, 2002, ISBN 0-471-22288-7 .
- ^ Benessere.com, inquadramento prognostico e stadiazione del CRC
- ^ Implementing Colorectal Cancer Screening. Workshop Summary , su iom.edu , The National Academies Press, 11 -12 - 2008. URL consultato il 19 dicembre 2008 (archiviato dall' url originale il 24 aprile 2009) .
- ^ Sito di saluter sul programma di screening in Emilia-Romagna Archiviato il 2 maggio 2007 in Internet Archive .
- ^ Tommaso G. Lubrano, "Al centro universitario di Torino <<Chirurgia gentile>> per il cancro al colon La sopravvivenza determinata dalla prevenzione primaria", La Stampa - Tuttoscienze, 24/01/2001 Copia archiviata ( PDF ), su ernia.org . URL consultato il 3 marzo 2010 (archiviato dall' url originale il 12 settembre 2014) .
- ^ Sito Farmalem Archiviato il 12 aprile 2009 in Internet Archive .
- ^ Valutazione del CEA nella prognosi e nella stadiazione del cancro del colon-retto, sito biomedica.net , su biomedia.net . URL consultato il 20 gennaio 2009 (archiviato dall' url originale il 22 dicembre 2008) .
- ^ Documento dell'università di Modena sul follow-up del cancro del colon-retto Archiviato il 1º giugno 2012 in Internet Archive .
- ^ Etsuko Hamada, Terumi Taniguchi e Satoshi Baba, Investigation of unexpected serum CA19-9 elevation in Lewis-negative cancer patients , in Annals of Clinical Biochemistry , vol. 49, Pt 3, 2012-05, pp. 266-272, DOI : 10.1258/acb.2011.011213 . URL consultato il 17 maggio 2021 .
- ^ Jolanda Stiksma, Diana C. Grootendorst e Peter Willem G. van der Linden, CA 19-9 as a marker in addition to CEA to monitor colorectal cancer , in Clinical Colorectal Cancer , vol. 13, n. 4, 2014-12, pp. 239-244, DOI : 10.1016/j.clcc.2014.09.004 . URL consultato il 17 maggio 2021 .
- ^ Igor Monsellato, Timing To Minimally Invasive Surgery After Neoadjuvant Chemoradiotherapy For Rectal Cancer: A Multicenter Randomized Controlled Trial - Biomarkers SubStudy , NCT03962088, clinicaltrials.gov, 14 febbraio 2020. URL consultato il 13 maggio 2021 .
- ^ ( EN ) Igor Monsellato, Elisabetta Garibaldi e Elisa Cassinotti, Expression levels of circulating miRNAs as biomarkers during multimodal treatment of rectal cancer - TiMiSNAR-mirna: a substudy of the TiMiSNAR Trial (NCT03962088) , in Trials , vol. 21, n. 1, 2020-12, p. 678, DOI : 10.1186/s13063-020-04568-9 . URL consultato il 17 maggio 2021 .
- ^ Informazioni sulla colonscopia su paginemediche.it Archiviato il 26 dicembre 2008 in Internet Archive .
- ^ Pagina sul clisma opaco, sito della SIRM , su sirm.org . URL consultato il 20 gennaio 2009 (archiviato dall' url originale il 3 febbraio 2009) .
- ^ a b c Giorgio Cittadini, Diagnostica per immagini e radioterapia , ECIG, 2008, ISBN 978-88-7544-138-8 .
- ^ Sito dell'AIRC. Uso della TAC nella diagnosi di CRC
- ^ Uso della PET in oncologia , su fondazionesanraffaele.it , Fondazione San Raffaele. URL consultato l'8 marzo 2015 (archiviato dall' url originale il 10 aprile 2010) .
- ^ Ecografia delle metastasi epatiche su chirurgiadelfegato.it , su chirurgiadelfegato.it . URL consultato il 20 gennaio 2009 (archiviato dall' url originale il 3 dicembre 2008) .
- ^ Sito del ministero della salute. Pagina sul cancro del colon-retto Archiviato il 4 settembre 2009 in Internet Archive .
- ^ Sito web Ospedali della vita . Pagina sul cancro del colon-retto Archiviato il 21 aprile 2006 in Internet Archive .
- ^ Weitzel JN: Genetic cancer risk assessment. Putting it all together. Cancer 86:2483,1999. PMID 10630174
- ^ ANSA | Sanità: tumori colon-retto, test pesa DNA e fa la diagnosi
- ^ Diagnosi di CRC su startoncology [ collegamento interrotto ]
- ^ Sito della associazione romagnola per la ricerca dei tumori , inquadramento clinico e diagnosi di CRC Archiviato il 21 dicembre 2008 in Internet Archive .
- ^ Sito del dottor Iannetti , gastroenterologo ed endoscopista
- ^ Vincenzo Marigliano, Argomenti di geriatria , CESI, 2002, ISBN 978-88-86062-71-8 .
- ^ Stein A, Atanackovic, D, Bokemeyer, C, Current standards and new trends in the primary treatment of colorectal cancer , in European journal of cancer (Oxford, England : 1990) , 47 Suppl 3, Sep 2011, pp. S312–4, DOI : 10.1016/S0959-8049(11)70183-6 , PMID 21943995 .
- ^ a b c d e f Cunningham D, Atkin W, Lenz HJ, Lynch HT, Minsky B, Nordlinger B, Starling N, Colorectal cancer , in Lancet , vol. 375, n. 9719, 2010, pp. 1030-47, DOI : 10.1016/S0140-6736(10)60353-4 , PMID 20304247 .
- ^ ( EN ) Igor Monsellato, Filippo Alongi e Elisa Bertocchi, Standard (8 weeks) vs long (12 weeks) timing to minimally-invasive surgery after NeoAdjuvant Chemoradiotherapy for rectal cancer: a multicenter randomized controlled parallel group trial (TiMiSNAR) , in BMC Cancer , vol. 19, n. 1, 2019-12, p. 1215, DOI : 10.1186/s12885-019-6271-3 . URL consultato il 17 maggio 2021 .
- ^ Tumore del colon retto. Un progetto per ottimizzare il trattamento - Quotidiano Sanità , su www.quotidianosanita.it . URL consultato il 17 maggio 2021 .
- ^ Chemotherapy of metastatic colorectal cancer , in Prescrire Int , vol. 19, n. 109, October 2010, pp. 219-24, PMID 21180382 .
- ^ W Shaib, R Mahajan e B El-Rayes,Markers of resistance to anti-EGFR therapy in colorectal cancer , in Journal of gastrointestinal oncology , vol. 4, n. 3, 2013, pp. 308-18, DOI : 10.3978/j.issn.2078-6891.2013.029 , PMC 3712296 , PMID 23997942 .
- ^ editors, Vincent T. DeVita, Jr., Theodore S. Lawrence, Steven A. Rosenberg ; associate scientific advisors, Robert A. Weinberg, Ronald A. DePinho ; with 421 contributing authors, DeVita, Hellman, and Rosenberg's cancer : principles & practice of oncology , 8th, Philadelphia, Wolters Kluwer/Lippincott Williams & Wilkins, 2008, p. 1258, ISBN 978-0-7817-7207-5 .
- ^ Palliative or Supportive Care , su cancer.org , American Cancer Society. URL consultato il 20 agosto 2014 .
- ^ ASCO Provisional Clinical Opinion: The Integration of Palliative Care into Standard Oncology Care , su asco.org , ASCO. URL consultato il 20 agosto 2014 (archiviato dall' url originale il 21 agosto 2014) .
- ^ IJ Higginson e CJ Evans, What is the evidence that palliative care teams improve outcomes for cancer patients and their families? , in Cancer journal (Sudbury, Mass.) , vol. 16, n. 5, Sep–Oct 2010, pp. 423-35, DOI : 10.1097/PPO.0b013e3181f684e5 , PMID 20890138 .
- ^ Wasserberg N, Kaufman HS, Palliation of colorectal cancer , in Surg Oncol , vol. 16, n. 4, December 2007, pp. 299-310, DOI : 10.1016/j.suronc.2007.08.008 , PMID 17913495 .
- ^ Amersi F, Stamos MJ, Ko CY, Palliative care for colorectal cancer , in Surg. Oncol. Clin. N. Am. , vol. 13, n. 3, July 2004, pp. 467-77, DOI : 10.1016/j.soc.2004.03.002 , PMID 15236729 .
- ^ Box 3-1, Page 107 in: Elizabeth D Agabegi; Agabegi, Steven S., Step-Up to Medicine (Step-Up Series) , Hagerstwon, MD, Lippincott Williams & Wilkins, 2008, ISBN 0-7817-7153-6 .
- ^ Simmonds PC, Primrose JN, Colquitt JL, Garden OJ, Poston GJ, Rees M,Surgical resection of hepatic metastases from colorectal cancer: A systematic review of published studies , in Br. J. Cancer , vol. 94, n. 7, April 2006, pp. 982-99, DOI : 10.1038/sj.bjc.6603033 , PMC 2361241 , PMID 16538219 .
Bibliografia
Oncologia
- DeVita, Hellman, Lawrence, DeVita, Hellman, and Rosenberg's Cancer: Principles & Practice of Oncology , 8ª ed., Lippincott Williams & Wilkins, 2008, ISBN 978-0-7817-7207-5 .
- Gianni Bonadonna, Gioacchino Robustelli Della Cuna, Pinuccia Valgussa, Medicina oncologica , 8ª ed., Milano, Elsevier Masson, 2007, ISBN 978-88-214-2814-2 .
Patogenesi e genetica
- Pontieri - Russo - Frati, Patologia generale , 3ª ed., Padova, Piccin, 2005, ISBN 88-299-1734-6 .
- Giovanni Neri, Maurizio Genuardi, Genetica umana e medica , Milano, Elsevier, 2010, ISBN 88-214-3172-X .
Anatomia patologica
- Robbins e Cotran, Le basi patologiche delle malattie , 7ª ed., Torino - Milano, Elsevier Masson, 2008, ISBN 978-88-85675-53-7 .
- Mariuzzi, Anatomia patologica e correlazioni anatomo-cliniche , Padova, Piccin, 2006, ISBN 978-88-299-1769-3 .
Medicina interna
- Harrison, Principi di Medicina Interna , 16ª ed., New York - Milano, McGraw-Hill, 2006, ISBN 88-386-2459-3 .
- Claudio Rugarli, Medicina interna sistematica , 5ª ed., Masson, 2005, ISBN 978-88-214-2792-3 .
Diagnostica per immagini e radioterapia
- Giorgio Cittadini, Diagnostica per immagini e radioterapia , ECIG, 2008, ISBN 978-88-7544-138-8 .
Chirurgia
- Dionigi, Basi teoriche e Chirurgia generale - Chirurgia specialistica , 4ª ed., Padova, Elsevier Masson, 2006, ISBN 978-88-299-1654-2 .
- Mazzeo - Forestieri, Trattato di chirurgia oncologica , PICCIN - Nuova libreria, 2006, ISBN 88-214-2912-1 .
Terapia farmacologica, chemioterapia
- Brunton, Lazo, Parker, Goodman & Gilman - Le basi farmacologiche della terapia 11/ed , McGraw Hill, 2006, ISBN 978-88-386-3911-1 .
- Bertram G. Katzung, Farmacologia generale e clinica , Padova, Piccin, 2006, ISBN 88-299-1804-0 .
- Linee Guida [ collegamento interrotto ] dell'Associazione Italiana di Oncologia Medica per i tumori del colon-retto.
Radioembolizzazione
Linee Guida dell'European Association of Nuclear Medicine (EAMN) per la radioembolizzazione intrarteriosa delle lesioni primitive e delle metastasi epatiche.
Voci correlate
- Tumore
- FOLFIRI
- Polipo (medicina)
- Adenomatous Polyposis Coli
- Poliposi adenomatosa familiare
- Cancro colorettale ereditario non poliposico
- Sangue occulto
- Colonscopia
- Chirurgia del cancro rettale
- CEA-IgM
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su carcinoma del colon-retto
Wikimedia Commons contiene immagini o altri file su carcinoma del colon-retto
Collegamenti esterni
- AIRC, carcinoma del colon-retto , su airc.it .
- Radiologia Cremona. Pagina dedicata alla diagnosi strumentale del carcinoma del colon-retto , su radiologiacremona.it . URL consultato il 18 gennaio 2009 (archiviato dall' url originale il 6 marzo 2009) .
- Pagina web di Benessere.com su CRC , su benessere.com .
- Chirurgia Epatobiliare, Ospedale San Raffaele, Milano https://www.hsr.it/strutture/ospedale-san-raffaele/chirurgia-epatobiliare
| Classificazione e risorse esterne ( EN ) | ICD-10 : C18 , C20 e C21 ; OMIM : 114500 ; DiseasesDB : 2975 ; MedlinePlus : 000262 ; eMedicine : 277496 , 281237 e 993370 ; NCI : NCI ID ; |
| Controllo di autorità | LCCN ( EN ) sh90003388 · GND ( DE ) 4012122-7 · NDL ( EN , JA ) 00561235 |
|---|