Inhibitor enzimatic
Prin termenul inhibitor enzimatic se referă la o moleculă capabilă să stabilească o legătură chimică cu o enzimă , reducând astfel activitățile . De fapt, inhibitorul poate împiedica enzima în cataliza reacției sale, de exemplu prin împiedicarea intrării substratului în situsul activ al enzimei în sine. Legătura dintre enzimă și inhibitor poate fi reversibilă sau ireversibilă . Inhibitorii ireversibili reacționează de obicei cu enzima, modificând chimic reziduurile de aminoacizi esențiali pentru activitate. În schimb, inhibitorii reversibili se leagă non-covalent și produc diferite tipuri de inhibiție în funcție de care se leagă de enzimă, de complexul enzimă-substrat sau de ambele.
De asemenea, enzimele pot lega molecule capabile să le sporească activitatea, au spus activatorii enzimatici. Unele dintre aceste molecule nu sunt esențiale pentru cataliză, dar prezența lor o facilitează. Alții, cum ar fi cofactorii (de exemplu, ioni metalici precum calciu, fier, mangan) și coenzime (de exemplu, produse derivate din vitamine), sunt indispensabili, iar absența lor nu face posibil mecanismul enzimatic. Prin urmare, unii inhibitori enzimatici pot concura și pentru cofactori și coenzime și pot reduce activitatea catalitică în acest fel.
Inhibitori sintetici și naturali
Deoarece blocarea sau inhibarea enzimei poate provoca moartea selectivă a microorganismelor patogene sau corectarea unui dezechilibru metabolic , majoritatea medicamentelor disponibile comercial sunt tocmai inhibitori ai enzimei. Acesta este motivul pentru care descoperirea și îmbunătățirea lor reprezintă un domeniu important de cercetare în domeniul biochimiei și farmacologiei . Un inhibitor enzimatic cu caracter medicinal este adesea judecat prin specificitatea sa (lipsa legăturilor sale cu alte proteine ) și prin potența sa ( constanta sa de disociere , care indică concentrația necesară pentru a inhiba enzima). O specificitate și o potență ridicate asigură faptul că un medicament are puține efecte secundare și, prin urmare, toxicitate mai mică. Inhibitorii utilizați în mod obișnuit în sectorul agroalimentar sunt mulți pesticide .
Inhibitorii enzimatici nu sunt totuși exclusiv molecule sintetice: sunt adesea compuși naturali implicați în reglarea metabolismului . De exemplu, enzimele unei căi metabolice sunt adesea inhibate de produsele finale ale căii în sine. Acest tip de feedback negativ încetinește fluxul printr-o cale când produsele încep să se formeze și reprezintă o strategie importantă pentru menținerea „ homeostaziei într-o celulă . Alți inhibitori ai enzimei celulare sunt proteine care se leagă și inhibă o anumită enzimă țintă. Acest lucru permite controlul enzimelor care ar putea deteriora celula, cum ar fi proteaze sau nucleaze . Un exemplu important este inhibitorul ribonucleazei , care se leagă de această enzimă într-una dintre cele mai strânse legături proteină-proteină cunoscute. [1] Inhibitorii enzimatici naturali pot fi, de asemenea, otrăvuri și pot fi folosiți ca apărare împotriva prădătorilor sau ca armă pentru uciderea prăzii.
Inhibitori reversibili
Sunt molecule care se leagă non-covalent de enzimă, motiv pentru care, după îndepărtarea lor, enzima revine la funcționalitate.
Tipuri de inhibitori reversibili

Inhibitorii reversibili se leagă de enzime cu interacțiuni non-covalente, cum ar fi legarea hidrogenului , interacțiunea hidrofobă și legarea ionică . Legături slabe multiple între inhibitor și situl activ se combină pentru a produce legături puternice și specifice. Spre deosebire de substraturi și inhibitori ireversibili, inhibitorii reversibili nu conduc în general la o reacție chimică atunci când se leagă de enzimă și pot fi ușor îndepărtați prin diluare sau dializă .
Există trei tipuri de inhibitori enzimatici reversibili, clasificați în funcție de efectul cauzat de modificările concentrației substratului enzimatic asupra inhibitorului. [2]
- Inhibiția competitivă a lui Nell, inhibitorul concurează cu substratul în legarea de situsul activ al enzimei . Efectul este de a scădea concentrația enzimei libere disponibile pentru a reacționa: afinitatea enzimei cu substratul scade, dar viteza maximă care poate fi atinsă nu se modifică. Inhibitorii competitivi sunt adesea similari din punct de vedere structural cu substratul real.
- Inhibiția necompetitivă a lui Nell, inhibitorul se poate lega numai de complexul enzimă-substrat. Legarea inhibitorilor afectează legarea substratului și invers. Acest tip de inhibiție poate fi redus, dar nu blocat, prin creșterea concentrației substratului. Deși este posibil ca inhibitorii concurenți să se lege de situsul activ , acest tip de inhibiție rezultă în general din efectul alosteric , în care inhibitorul se leagă de un loc diferit al enzimei și produce o modificare alosterică a enzimei. Modificarea conformației (de exemplu a structurii terțiare sau a formei tridimensionale) a enzimei reduce astfel afinitatea substratului cu locul activ și eficiența enzimei.
- Inhibiția L ' necompetitivă și' inhibarea mixtă sunt inhibiții enzimatice de către molecule capabile să lege atât enzima liberă, cât și complexul enzimă-substrat. În funcție de constantele de inhibare Ki și Ki ', care identifică cele două echilibre ale inhibitorului "I" cu enzima liberă Ki și complexul Ki', efectul inhibitor are o magnitudine diferită. Dacă inhibitorul are afinitate identică atât pentru complex, cât și pentru enzimă, efectul este de a modifica atât viteza de reacție, cât și cantitatea de substrat necesare pentru a satura enzima (de la reacția de prim ordin la reacția de ordin zero). Dacă afinitatea inhibitorului este mai mare pentru complexul enzimatic substrat decât pentru enzima liberă, efectul este să acționeze semnificativ asupra eliberării produsului de cataliză: prin urmare, eficiența enzimei scade. Dacă, pe de altă parte, afinitatea inhibitorului este mai mare pentru enzima liberă, efectul este de a reduce enzima liberă disponibilă pentru cataliză (ca și pentru cea competitivă).
Descrierea cantitativă a inhibiției reversibile
Inhibiția reversibilă poate fi descrisă cantitativ în ceea ce privește legarea inhibitorului de enzimă și complexul enzimă-substrat și efectele sale asupra constantelor cinetice ale enzimei. În schema clasică a lui Michaelis-Menten , o enzimă (E) se leagă de substratul său (S) pentru a forma complexul enzimă-substrat ES. În timpul catalizei, acest complex se descompune pentru a elibera produsul P și enzima liberă. Inhibitorul (I) se poate lega de E sau ES cu constantele de disociere K i respectiv K i '.
- Inhibitorii competitivi se pot lega de E, dar nu de ES. Inhibarea competitivă crește K m (interferează cu inhibitor cu legarea substratului), dar nu are nici un efect asupra Vmax (inhibitorul nu împiedică catalizei în ES , deoarece nu se poate lega de ES).
- Inhibitorii necompetitivi au afinitate egală pentru E și ES (K i = K i '). Inhibarea necompetitivă nu se schimbă K m (nu afectează legătura cu substratul) dar scade V max (obligațiuni inhibitor de cataliză coșuri).
- Inhibitorii amestecați se vor lega atât de E care în ES, dar afinitatea lor pentru aceste două forme ale enzimei sunt diferite (K i ≠ K i '). Prin urmare, inhibitorii amestecați interferează cu legarea substratului (creștere Km ) și împiedică cataliza în complexul ES (scădere V max).
Dacă o enzimă are diferite substraturi, inhibitorii pot prezenta diferite tipuri de inhibiție în funcție de substratul în cauză. Acest lucru rezultă din site-ul activ care conține două site-uri de legare diferite, unul pentru fiecare substrat. De exemplu, un inhibitor poate concura cu substratul A pentru primul loc de legare, dar poate fi un inhibitor necompetitiv cu substratul B la al doilea loc de legare. [3]
Măsurarea constantelor de disociere ale unui inhibitor reversibil
După cum sa discutat deja, un inhibitor enzimatic se caracterizează prin două constante de disociere : K i (relativ la E) și K i '(relativ la ES complex).
Constanta K i poate fi măsurată direct prin diferite metode; o metodă extrem de precisă este calorimetria de titrare izotermă , în care se măsoară concentrația inhibitorului într-o soluție cu enzime și căldura eliberată sau absorbită. [4] Constanta K i 'este totuși dificil de măsurat direct, deoarece complexul enzimă-substrat este de scurtă durată și este susceptibil de reacții chimice pentru a forma produsul. Prin urmare, K i 'este uneori măsurat indirect prin observarea activității enzimatice pe diferite substraturi și concentrații de inhibitori și prin interpolare a datelor [5] într-o ecuație a lui Michaelis-Menten modificată după cum urmează:
unde factorii modificatori α și α 'sunt definiți de concentrația inhibitorului și de cele două constante de disociere
Astfel, în prezența inhibitorului, efectiv m K și V max devin respectiv enzimă (α / α ') și K m (1 / α') V max. Cu toate acestea, ecuația Michaelis-Menten modificată presupune că legarea inhibitorului de enzimă a ajuns la echilibru, care poate fi un proces foarte lent pentru inhibitori cu constante de disociere foarte scăzute (sub-nanomolar). În aceste cazuri, este mai practic să tratați inhibitorul ca un inhibitor ireversibil (așa cum este descris mai jos); Cu toate acestea, poate fi totuși posibil să se estimeze K cinetic „ în cazul în care K i se măsoară în mod independent.
Efectele diferitelor tipuri de inhibitori de enzime reversibile asupra activității enzimatice pot fi afișate cu reprezentări grafice ecuația Michaelis-Menten, precum Lineweaver-Burk și graficul Eadie-Hofstee . De exemplu, în graficul Lineweaver-Burk al liniilor de inhibiție competitive se intersectează pe axa y, arătând că astfel de inhibitori nu afectează V max. În mod similar, liniile de inhibiție necompetitive se intersectează pe axa x , deoarece astfel de inhibitori nu afectează Km . Cu toate acestea, poate fi dificil să se estimeze exact K i și K i 'din astfel de grafice [6] , motiv pentru care este obișnuit să se estimeze aceste constante utilizând cea mai fiabilă regresie neliniară descrisă mai sus.
Cazuri speciale
- Mecanismul „inhibiției parțial competitive este similar cu cel al necompetitivului, cu excepția faptului că complexul EIS are o activitate catalitică mai mică decât cea a complexului ES. Această inhibiție afișează de obicei un V max mai mic , dar o valoare neschimbată de Km . [7]
- L ' inhibiție necompetitivă apare atunci când inhibitorul se leagă numai de complexul enzimă-substrat, enzima nu este liberă; complexul EIS este inactiv catalitic. Acest mod de inhibare este rar și determină o scădere atât a V max cât și a Km . [7]
- L 'inhibarea substratului sau a produsului are loc atunci când substratul sau produsul unei reacții catalizate de o enzimă inhibă activitatea enzimatică. Această inhibiție poate urma modelele celei competitive, necompetitive sau mixte. În inhibarea substratului există o scădere progresivă a activității pentru concentrații mari de substrat. Acest lucru poate indica existența a două situsuri de legare în enzimă. O concentrație scăzută de substrat, site-ul este ocupat cu afinitate ridicată și cinetica enzimei normale este respectată. Cu toate acestea, la concentrații mai mari, al doilea loc (inhibitor) este, de asemenea, ocupat. [8] Inhibarea produsului este adesea o caracteristică a metabolismului reglator și poate fi o formă de feedback negativ .
- L 'inhibarea lent-strânsă apare atunci când complexul inițial EI suferă (prin izomerizare ) un complex mai strâns EI * (procesul general de inhibare este reversibil). Acest eveniment apare la fel de lent pe măsură ce inhibarea enzimei crește. În aceste condiții, cinetica tradițională Michaelis-Menten oferă o valoare incorectă a lui K i, care depinde de timp. Valoarea reală a Kj poate fi realizat printr -o analiză mai complexă asupra relației dintre constantele (kon) și oprit (koff) asociere inhibitoare.
Exemple de inhibitori reversibili

Deoarece enzimele sunt menite să se lege strâns de substratele lor, iar majoritatea inhibitorilor reversibili se leagă de locul activ al enzimei, nu este surprinzător faptul că unii dintre acești inhibitori sunt foarte asemănători ca structură cu substratul enzimei țintă. Un exemplu în acest sens îl constituie inhibitorii mimetici ai proteazei , cum ar fi ritonavir , o clasă de medicamente anti retrovirale utilizate de exemplu pentru tratarea infecțiilor cu HIV . [9] Inhibitorii sunt adesea capabili să imite starea de tranziție , intermediarul unei reacții catalizate de enzimă. Acest lucru asigură că inhibitorul exploatează efectul stabilizator al stării de tranziție enzimatică, dând naștere la o afinitate de legare mai bună (K i mai mică decât Km ) în raport cu substratul. Un exemplu de astfel de inhibitor al tranziției stării este oseltamivirul antiviral, care imită natura plană a ionului inel oxoniu în reacția enzimatică neuraminidază virală.

Cu toate acestea, nu toți inhibitorii reversibili imită structurile substratului. Structura unui alt inhibitor al proteazei HIV, cum ar fi tipranavir , de exemplu, nu este de tip peptidă și nu are asemănări structurale evidente cu substratul. Acești inhibitori non-peptidici pot fi mai stabili decât cei care conțin legături peptidice, deoarece nu constituie un substrat pentru peptidază și sunt mai greu degradați în celulă .
În proiectarea medicamentelor, este necesară și o evaluare atentă a concentrațiilor necesare pentru a induce o concurență eficientă. De exemplu, este posibil să se inhibe protein kinaza prin molecule cu structură chimică similară cu ' ATP (unul dintre substraturile acestor enzime), dar astfel de medicamente vor trebui să concureze cu concentrațiile mari de ATP din celulă . Prin urmare, în unele cazuri, este de preferat să se dezvolte inhibitori ai protein kinazelor care concurează pentru situsul lor de legare cu substraturile proteice relative, prezente în celule la concentrații mult mai mici decât concentrația standard de ATP. O concentrație mult mai mică a acestui al doilea tip de inhibitor va fi, prin urmare, suficientă pentru a obține un rezultat similar cu cel indus de primul tip de medicament. [10]
Inhibitori ireversibili
Tipuri de inhibiție ireversibilă
Inhibitorii ireversibili modifică de obicei covalent enzima și, prin urmare, inhibarea nu poate fi neutralizată ulterior. Adesea acești inhibitori conțin grupuri funcționale reactive ca aldehide , haloalcani sau alchene . Aceste grupuri electrofile reacționează cu lanțurile laterale ale aductilor covalenți ai aminoacizilor. Reziduurile modificate sunt cele cu lanțuri laterale care conțin grupuri nucleofile, cum ar fi „ hidroxil sau sulfhidril (de exemplu, serină , vizabilă din diizopropilfluorofosfato , cisteină , treonină sau tirozină ). [11]
Conceptul de inhibiție ireversibilă este în orice caz diferit de cel de inactivare ireversibilă a enzimei. Inhibitorii ireversibili sunt de obicei specifici unei clase de enzime și nu inactivează toate proteinele; Acestea nu funcționează prin distrugerea structurii proteinelor, ci prin modificarea specifică a sitului activ al țintei lor. Inhibitorii ireversibili, prin urmare, nu sunt legați de fenomene legate de niveluri extreme de pH sau temperatură , care cauzează de obicei denaturarea nespecifică a tuturor structurilor proteice prezente în soluție sau hidroliza nespecifică mediată prin adăugarea în mijlocul acidului clorhidric concentrat la cald, care generează o spargere a legăturilor peptidice și o eliberare de aminoacizi liberi . [12]
Analiza de inhibare ireversibilă
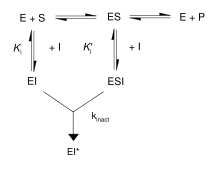
Inhibitorii ireversibili formează un complex reversibil non-covalent cu enzima (EI sau ESI), care reacționează pentru a produce un complex modificat și definit covalent EI * sau impas (fără ieșire). Raportul în care este format EI * este raportat la raportul de inactivare (sau k inact). Deoarece formarea EI poate concura cu ES, legarea inhibitorilor ireversibili poate fi evitată prin concurența cu un substrat sau un al doilea inhibitor reversibil.
Mecanismele de legare și inactivare ale acestui tip de reacție pot fi investigate prin incubarea enzimei și a inhibitorului și măsurarea cantității de activitate rămasă în timp. Activitatea scade într-o manieră dependentă de timp, de obicei după o descompunere exponențială . Aducerea acestor date într-o ecuație de relație se obține prin rata de inactivare la acea concentrație de inhibitor. Această operație se repetă la diferite concentrații ale inhibitorului. Dacă este implicat un complex EI reversibil, rata de inactivare va fi saturabilă și, trasând curba, veți obține K i și k inactivi. [13]
O altă metodă larg utilizată în aceste analize este spectrometria de masă . În acest caz, o măsurare exactă a masei enzimei nemodificate originale și a enzimei inactivate permite calcularea creșterii masei cauzată de reacția cu inhibitorul și arată stoichiometria reacției. Acest lucru poate fi investigat folosind un spectrometru de masă MALDI-TOF. O tehnică complementară, amprenta proteinei , implică digestia proteinei originale și modificată de o protează, cum ar fi tripsina . Aceasta produce un set de peptide care pot fi analizate cu un spectrometru de masă. Peptida a cărei masă se modifică după reacția cu inhibitorul este una care conține locul modificării.
Cazuri speciale

Adesea, unii inhibitori reversibili sunt capabili să se lege atât de strâns de ținta lor încât să pară ireversibili. Acești inhibitori prezintă constante cinetice similare cu cele ale inhibitorilor covalenți ireversibili. În aceste cazuri, unii dintre acești inhibitori se leagă rapid de enzimă în complexul EI cu afinitate scăzută și acesta suferă apoi o rearanjare mai lentă la un complex EI * foarte ferm legat. Un astfel de comportament cinetic este definit de legătură lentă [15] . Exemple de inhibitori de legare lentă sunt alcătuite din medicamente importante, cum ar fi metotrexatul [16] , l ' alopurinol [17] și forma activată a aciclovirului . [18]
Exemple de inhibitori ireversibili

Diisopropilfluorofosfato (DFP) este un inhibitor al proteazei, care hidrolizează legătura fosfor - fluor lăsând fosfatul legat de serina prezentă în situsul activ , prin inhibarea enzimei într-o manieră ireversibilă. [19] În mod similar, DFP reacționează, de asemenea, cu situl activ al ' acetilcolinesterazei în sinapsele neuronilor și, prin urmare, este, de asemenea, o neurotoxină puternică, a cărei doză letală este fixată la mai puțin de 100 mg. [20]
Un alt exemplu de inhibitor de protează ireversibil este iodoacetamida, care se leagă de un reziduu de cisteină al enzimei. Conținutul de sulf aminacid reacționează cu un astfel de inhibitor, formează un acid ioidrico care eliberează tioeter (HI). Enzima își pierde apoi activitatea.
Inhibarea sinuciderii este un tip neobișnuit de inhibiție ireversibilă care apare atunci când enzima transformă inhibitorul într-o formă reactivă la locul său activ. Un exemplu este „ α-difluorometilornitina (sau DFMO), un inhibitor al biosintezei poliaminelor și a ornitinei aminoacidului similar, utilizat pentru tratarea tripanosomiazei africane (febra somnului). L ' ornitină decarboxilaza poate cataliza decarboxilarea DFMO în loc de ornitină. O consecință a acestei reacții este eliminarea unui atom de fluor, care transformă acest conjugat intermediar catalinic nell ' imine , o specie extrem de electrofilă, care reacționează cu un reziduu de cisteină sau lizină din locul activ pentru a inhiba ireversibil enzima. [14]
Deoarece inhibarea ireversibilă dă naștere adesea formării inițiale a unui complex EI non-covalent, este uneori posibil ca un inhibitor să se lege de o enzimă în mai multe moduri. De exemplu, un inhibitor numit muștar chinacrin poate inhiba în două moduri diferite trypanothione reductaza protozoarului Trypanosoma cruzi . Într-un caz, se poate lega reversibil, altul covalent, deoarece reacționează cu un reziduu de aminoacizi prin muștarul său de azot . [21]
Descoperirea și proiectarea inhibitorilor
Noile medicamente sunt produsul unei faze lungi de dezvoltare, al cărei prim pas este adesea descoperirea unui nou inhibitor enzimatic. În trecut, singura modalitate de a descoperi acești noi inhibitori a fost abordarea „încercării și erorilor”: supunerea unei enzime țintă la acțiunea unei varietăți de compuși care speră să descopere unele interacțiuni inhibitoare utile. Această metodă este încă utilizată cu succes și a fost extinsă prin abordarea chimiei combinatorii , care produce rapid un număr mare de compuși noi și prin tehnologiile HTS , care permit exploatarea acestor mari biblioteci de compuși chimici utili ca inhibitori.
Recent, folosim o abordare alternativă: proiectarea rațională a medicamentelor, care utilizează structura tridimensională a situsului activ al enzimei pentru a detecta moleculele care pot acționa ca inhibitori. Aceste ipoteze sunt apoi verificate și unul dintre compușii testați va deveni noul inhibitor. Acest nou inhibitor este apoi utilizat pentru a obține un complex EI, care va fi apoi analizat pentru a determina și, ulterior, pentru a optimiza, tipul de legătură care se stabilește între moleculă și enzimă în situsul activ. Acest ciclu de testare și îmbunătățire poate fi repetat pentru a produce un inhibitor suficient de puternic (cu o constantă de disociere < 10-9 M [22] ).
Utilizați inhibitori
Inhibitorii enzimatici se găsesc în natură și sunt sintetizați în mod artificial pentru utilizare în domeniul farmacologiei și biochimiei . Otravurile naturale sunt, de asemenea, deseori inhibitori de enzime, dezvoltate pentru a proteja plantele și animalele de prădători . Aceste toxine naturale includ unii dintre cei mai otrăvitori compuși cunoscuți astăzi. Inhibitorii artificiali sunt adesea utilizați ca medicamente, dar pot fi și insecticide precum malation , erbicide precum glifosat sau dezinfectanți precum triclosan .
Farmacologie
 Structura sildenafilului ( Viagra ). |
 Coenzima acidului folic (stânga) în comparație cu medicamentul anticancer metotrexat (dreapta). |
 Structura unui complex între penicilina G și transpeptidaza Streptomyces . Generat din PDB 1PWC . |
Cea mai frecventă utilizare a inhibitorilor enzimatici este sinteza medicamentelor. Multe dintre ele, de fapt, vizează enzimele umane și pot corecta unele situații patologice. Cu toate acestea, nu toate medicamentele sunt inhibitori ai enzimelor. Unele, cum ar fi medicamentele antipileptice , modifică activitatea enzimei rezultând o producție mai mare sau mai mică de enzimă. Aceste efecte se numesc inducție și inhibare enzimatică și sunt derivate din modificări ale expresiei genelor , care nu sunt legate de inhibarea enzimei descrise până acum. Alte medicamente interacționează cu diferite ținte celulare de către enzime, cum ar fi canalele ionice sau receptorii de membrană .
Un exemplu interesant de inhibitor al enzimei medicinale este sildenafilul , ingredientul activ al Viagra , (figura dreaptă), un tratament obișnuit pentru disfuncția erectilă masculină. Acest compus este un inhibitor puternic al fosfodiesterazei-5 , enzima care degradează molecula ciclică de guanozină monofosfat . [23] Această moleculă, care îndeplinește funcția de semnal , determină relaxarea mușchilor netezi și permite sângelui să curgă în corpul cavernos , rezultând erecția . Medicamentul, prin scăderea activității enzimei care blochează semnalul, îl menține pe acesta din urmă pentru o perioadă mai lungă de timp.
Un alt exemplu de similaritate structurală a unor inhibitori cu substraturile enzimelor țintă este reprezentat în figură, în care compară medicamentul metotrexat cu acidul folic . Acidul folic este forma oxidată a substratului dihidrofolat reductazei , o enzimă puternic inhibată de metotrexat. Il Methotrexate blocca l'azione del diidrofolato reduttasi fermando quindi la biosintesi della timidina . Questo blocco della biosintesi nucleotidica è selettivamente tossica per le cellule che crescono rapidamente, e per questo motivo il methotrexate è spesso usato nella chemioterapia . [24]
Gli inibitori usati in farmacologia servono anche ad inibire gli enzimi necessari alla sopravvivenza dei microorganismi patogeni . Ad esempio, i batteri sono protetti da una spessa parete cellulare formata da peptidoglicani . Molti antibiotici come la penicillina e la vancomicina inibiscono gli enzimi che li producono. [25] Questo provoca una perdita di resistenza della parete e la sua rottura. Nella figura, una molecola di penicillina si lega al suo bersaglio, la transpeptidasi del batterio Streptomyces R61.
La ricerca sui farmaci è facilitata quando un enzima essenziale per la sopravvivenza di un patogeno è assente, o presente in una forma molto diversa, nell'uomo. Nell'esempio sopra, gli esseri umani non producono peptidoglicani, e quindi gli inibitori di questo processo sono selettivamente tossici per i batteri. La tossicità selettiva degli antibiotici può anche sfruttare le differenze nella struttura dei ribosomi batterici, o quelle relative alla biosintesi degli acidi grassi . Il concetto di tossicità selettiva risale agli studi pionieristici di chemioterapia condotti dal medico tedesco Paul Ehrlich nei primi anni del Novecento.
Controllo metabolico
Gli inibitori enzimatici sono molto importanti anche nel controllo metabolico. Molti pathways metabolici nella cellula sono inibiti da metaboliti che controllano l'attività enzimatica attraverso la regolazione allosterica o l'inibizione del substrato. Un esempio è costituito dal pathway glicolitico . Questo pathway catabolico consuma glucosio e produce ATP , NADH e piruvato . Un passaggio chiave nella regolazione della glicolisi è la reazione iniziale catalizzata dalla fosfofruttochinasi-1 (PFK1). Quando i livelli di ATP crescono, l'ATP si lega ad un sito allosterico nella PFK1 per abbassare la velocità di reazione dell'enzima; la glicolisi è inibita e la produzione di ATP scende. Questo controllo basato su un feedback negativo aiuta a mantenere una concentrazione stabile di ATP nella cellula. Tuttavia, i pathways metabolici non sono regolati solo attraverso l'inibizione in quanto l'attivazione è ugualmente importante. Rispetto alla PFK1, il fruttosio 2,6-difosfato e l' ADP sono esempi di attivatori allosterici. [26]
L'inibizione fisiologica degli enzimi può anche essere prodotta da inibitori proteici specifici. Questo meccanismo avviene nel pancreas , che sintetizza molti precursori di enzimi digestivi noti come zimogeni . Molti di essi sono attivati dalla proteasi tripsina , perciò è importante inibire l'attività della tripsina nel pancreas per prevenire l'"autodistruzione" dell'organo. Un modo in cui l'attività della tripsina viene controllata è la produzione di uno specifico e potente inibitore nel pancreas. Questo inibitore si lega saldamente alla tripsina, bloccando l'attività che potrebbe danneggiare seriamente l'organo. [27] Nonostante l'inibitore della tripsina sia una proteina , essa evita la sua idrolisi, come substrato dalla proteasi, escludendo l' acqua dal sito attivo della tripsina e destabilizzando lo stato di transizione. [28] Altri esempi di inibitori enzimatici fisiologici proteici includono l'inibitore barstar della ribonucleasi batterica barnasi [29] e gli inibitori delle protein fosfatasi . [30]
Inibitori dell'acetilcolinesterasi
L' Acetilcolinesterasi (AChE) è un enzima presente in tutti gli animali, dagli insetti all'uomo. È essenziale per la funzionalità delle cellule nervose per la sua capacità di scindere il neurotrasmettitore acetilcolina nei suoi costituenti, l' acetato e la colina . Questo meccanismo è pressoché unico tra i neurotrasmettitori dal momento che la maggior parte, tra cui la serotonina , la dopamina , e la norepinefrina , non è scomposta, ma assorbita dalla membrana postisinaptica . Un gran numero di inibitori dell'AChE sono utilizzati sia in medicina che in agricultura . Inibitori competitivi reversibili, come l' edrofonio , la fisostigmina , e la neostigmina , sono usati nel trattamento della Miastenia gravis ed in anestesia . Altri esempi di inibitori dell'acetilcolinesterasi sono gli insetticidi di terza generazione, quali i carbammati e gli organofosfati .
Veleni naturali

Animali e piante, nel corso della loro evoluzione, hanno sviluppato la capacità di sintetizzare un'ampia gamma di sostanze velenose, tra cui metaboliti secondari , peptidi e proteine che possono agire quali inibitori. Le tossine naturali sono di solito piccole molecole organiche e sono così varie e diffuse che, probabilmente, vi sono inibitori naturali per la maggior parte dei processi metabolici. [31] I processi metabolici cui si rivolgono i veleni naturali non interessano soltanto gli enzimi nei pathways metabolici, ma possono anche includere l'inibizione di recettori, proteine canale o strutturali nella cellula. Per esempio, il paclitaxel (taxolo), una molecola organica presente nel Taxus , si lega strettamente ai dimeri di tubulina e inibisce la loro unione nei microtubuli del citoscheletro . [32]
Molti veleni naturali agiscono come neurotossine che provocano paralisi e possono quindi condurre alla morte . Tali veleni sono usati sia come mezzi di difesa contro i predatori, sia per cacciare e catturare le prede. Alcuni di questi inibitori naturali, nonostante i loro attributi tossici, a dosi più basse sono utili per usi terapeutici. [33] Un esempio di neurotossina sono i glucoalcaloidi , presenti nella famiglia delle Solanaceae ( patate , pomodori e melanzane ), che sono inibitori dell' acetilcolinesterasi . L'inibizione di questo enzima causa una produzione incontrollata di acetilcolina , la paralisi muscolare e quindi la morte. La neurotossicità può anche derivare dall'inibizione dei recettori; per esempio, l' atropina prodotta dall' Atropa belladonna funziona come un antagonista competitivo dei recettori dell'acetilcolina. [34]
Nonostante molte tossine naturali siano metaboliti secondari, questi veleni includono anche peptidi e proteine. Un esempio di peptide tossico è l' α-amanitina , presente nell' amanita falloide e in specie correlate. Si tratta di un potente inibitore enzimatico, che impedisce la trascrizione del DNA da parte dell' RNA polimerasi II . [35] La tossina microcistina , presente nelle alghe, è anch'essa un peptide ed è un inibitore della protein fosfatasi . [36] Questa tossina può contaminare le fonti d'acqua dopo la fioritura algale ed è un noto agente cancerogeno che può anche causare emorragie epatiche acute e la morte, se assunta a dosi elevate. [37]
Anche le proteine possono essere veleni naturali, come l'inibitore della tripsina che si trova in alcune lenticchie , come mostrato nella figura sopra. Una classe meno comune di tossine è rappresentata dagli enzimi tossici, che agiscono come inibitori irreversibili dei loro bersagli e modificano chimicamente i loro enzimi substrato. Un esempio è dato dalla ricina , una potentissima tossina proteica rilevata nei chicchi del Ricinus communis . Questo enizima è una glicosidasi che inibisce i ribosomi . Poiché la ricina è un inibitore catalitico irreversibile, una sola molecola di questo composto è in grado di uccidere una cellula. [38]
Note
- ^ Shapiro R, Vallee BL. Interaction of human placental ribonuclease with placental ribonuclease inhibitor. Biochemistry. 1991 Feb 26;30(8):2246–55. PMID 1998683
- ^ Berg J., Tymoczko J. and Stryer L. (2002) Biochemistry. WH Freeman and Company ISBN 0-7167-4955-6
- ^ *Irwin H. Segel, Enzyme Kinetics : Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems . Wiley–Interscience; New edition (1993), ISBN 0-471-30309-7
- ^ Holdgate GA. Making cool drugs hot: isothermal titration calorimetry as a tool to study binding energetics. Biotechniques. 2001 Jul;31(1):164–6 PMID 11464510
- ^ Leatherbarrow RJ. Using linear and non-linear regression to fit biochemical data. Trends Biochem Sci. 1990 Dec;15(12):455–8. PMID 2077683
- ^ Tseng SJ, Hsu JP. A comparison of the parameter estimating procedures for the Michaelis–Menten model. J Theor Biol. 1990 Aug 23;145(4):457–64. PMID 2246896
- ^ a b Irwin H. Segel, Enzyme Kinetics : Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems . Wiley-Interscience; New Ed edition (1993), ISBN 0-471-30309-7
- ^ Dixon, M. Webb, EC, Thorne, CJR and Tipton KF, Enzymes (3rd edition) Longman, London (1979) See p. 126
- ^ Hsu JT, Wang HC, Chen GW, Shih SR. Antiviral drug discovery targeting to viral proteases. Curr Pharm Des. 2006; 12(11):1301–14. PMID 16611117
- ^ Bogoyevitch MA, Barr RK, Ketterman AJ. Peptide inhibitors of protein kinases—discovery, characterisation and use. Biochim Biophys Acta. 2005 Dec 30;1754(1-2):79–99. PMID 16182621
- ^ Lundblad RL Chemical Reagents for Protein Modification CRC Press Inc (2004) ISBN 0-8493-1983-8
- ^ N. Price, B. Hames, D. Rickwood (Ed.) Proteins LabFax Academic Press (1996) ISBN 0-12-564710-7
- ^ Maurer T, Fung HL. Comparison of Methods for Analyzing Kinetic Data From Mechanism-Based Enzyme Inactivation: Application to Nitric Oxide Synthase. AAPS PharmSci. (2000) 2(1)E8. PMID 11741224
- ^ a b Poulin R, Lu L, Ackermann B, Bey P, Pegg AE. Mechanism of the irreversible inactivation of mouse ornithine decarboxylase by alpha-difluoromethylornithine. Characterization of sequences at the inhibitor and coenzyme binding sites. Archiviato il 24 gennaio 2009 in Internet Archive . J Biol Chem. 1992 Jan 5;267(1):150–8. PMID 1730582
- ^ Szedlacsek, SE and Duggleby, RG Kinetics of slow and tight-binding inhibitors. Meth. Enzymol., (1995) 249: 144–180. PMID 7791610
- ^ Stone SR, Morrison JF. Mechanism of inhibition of dihydrofolate reductases from bacterial and vertebrate sources by various classes of folate analogues. Biochim Biophys Acta. 1986 Feb 14;869(3):275–85. PMID 3511964
- ^ Hille R, Massey V. Tight binding inhibitors of xanthine oxidase. Pharmacol Ther. 1981;14(2):249–63. PMID 4322209
- ^ Reardon JE. Herpes simplex virus type 1 and human DNA polymerase interactions with 2'-deoxyguanosine 5'-triphosphate analogues. Kinetics of incorporation into DNA and induction of inhibition. Archiviato il 24 gennaio 2009 in Internet Archive . J Biol Chem. 1989 Nov 15;264(32):19039–44. PMID 2553730
- ^ JA Cohen , RA Oosterbaan and F. Berends Organophosphorus compounds Meth. Enzymol. (1967) 11, 686
- ^ Brenner, GM (2000): Pharmacology. Philadelphia, PA: WB Saunders Company. ISBN 0-7216-7757-6
- ^ Saravanamuthu A, Vickers TJ, Bond CS, Peterson MR, Hunter WN, Fairlamb AH. Two interacting binding sites for quinacrine derivatives in the active site of trypanothione reductase: a template for drug design. Archiviato il 12 maggio 2009 in Internet Archive . J Biol Chem. 2004 Jul 9;279(28):29493–500. PMID 15102853
- ^ Hunter WN. Rational drug design: a multidisciplinary approach. Mol Med Today. 1995 Apr;1(1):31, 34. PMID 9415135
- ^ Maggi M, Filippi S, Ledda F, Magini A, Forti G. Erectile dysfunction: from biochemical pharmacology to advances in medical therapy. Archiviato il 28 settembre 2007 in Internet Archive . Eur J Endocrinol. 2000 Aug;143(2):143–54 PMID 10913932
- ^ McGuire JJ. Anticancer antifolates: current status and future directions. Curr Pharm Des. 2003;9(31):2593–613. PMID 14529544
- ^ Katz AH, Caufield CE. Structure-based design approaches to cell wall biosynthesis inhibitors. Curr Pharm Des. 2003;9(11):857–66. PMID 12678870
- ^ Okar DA, Lange AJ. Fructose-2,6-bisphosphate and control of carbohydrate metabolism in eukaryotes. Biofactors. 1999;10(1):1–14.
- ^ Nicholas Price, Lewis Stevens, Fundamentals of Enzymology , Oxford University Press, (1999) ISBN 0-19-850229-X
- ^ Smyth TP. Substrate variants versus transition state analogues as noncovalent reversible enzyme inhibitors. Bioorg Med Chem. 2004 Aug 1;12(15):4081–8. PMID 15246086
- ^ Hartley RW. Barnase and barstar: two small proteins to fold and fit together. Trends Biochem Sci. 1989 Nov;14(11):450–4. PMID 2696173
- ^ Oliver CJ, Shenolikar S. Physiologic importance of protein phosphatase inhibitors. Front Biosci. 1998 Sep 1;3:D961–72. PMID 9727084
- ^ Tan G, Gyllenhaal C, Soejarto DD. Biodiversity as a source of anticancer drugs. Curr Drug Targets. 2006 Mar;7(3):265-77. PMID 16515527
- ^ Abal M, Andreu JM, Barasoain I. Taxanes: microtubule and centrosome targets, and cell cycle dependent mechanisms of action. Curr Cancer Drug Targets. 2003 Jun;3(3):193–203. PMID 12769688
- ^ Hostettmann K, Borloz A, Urbain A, Marston A, Natural Product Inhibitors of Acetylcholinesterase Current Organic Chemistry, 2006 May;10(8):825-47
- ^ DeFrates LJ, Hoehns JD, Sakornbut EL, Glascock DG, Tew AR. Antimuscarinic intoxication resulting from the ingestion of moonflower seeds. Ann Pharmacother. 2005 Jan;39(1):173-6. PMID 15572604
- ^ Vetter J. Toxins of Amanita phalloides. Archiviato il 12 maggio 2009 in Internet Archive . Toxicon. 1998 Jan;36(1):13–24. PMID 9604278
- ^ Holmes CF, Maynes JT, Perreault KR, Dawson JF, James MN. Molecular enzymology underlying regulation of protein phosphatase-1 by natural toxins. Curr Med Chem. 2002 Nov;9(22):1981-9. PMID 12369866
- ^ Bischoff K. The toxicology of microcystin-LR: occurrence, toxicokinetics, toxicodynamics, diagnosis and treatment. Vet Hum Toxicol. 2001 Oct;43(5):294-7. PMID 11577938
- ^ Hartley MR, Lord JM. Cytotoxic ribosome-inactivating lectins from plants. Archiviato il 12 maggio 2009 in Internet Archive . Biochim Biophys Acta. 2004 Sep 1;1701(1-2):1–14. PMID 15450171
Voci correlate
- Inibizione enzimatica retroattiva da prodotto finale
- Inibitore reversibile
- Inibitore irreversibile
- Inibitore competitivo
- Inibitore non competitivo
- Inibitore acompetitivo
- Inibitore di tipo misto
- Inibitore suicida
- Enzima
- Catalisi enzimatica
- Allosteria
- Regolazione allosterica
- Chimica farmaceutica
- Farmacoforo
Collegamenti esterni
- ( EN ) Web tutorial on enzyme inhibition , dispensa di Peter Birch della University of Paisley, con animazioni
- ( EN ) Symbolism and Terminology in Enzyme Kinetics , consigli sulla terminologia di inibizione enzimatica ad opera del Nomenclature Committee of the International Union of Biochemistry (NC-IUB)
- ( EN ) PubChem from NCBI , database di farmaci ed inibitori enzimatici
- ( EN ) BRENDA , database degli enzimi con i relativi inibitori noti
- ( EN ) Enzymes, Kinetics and Diagnostic Use , testo sulle applicazioni mediche degli inibitori enzimatici di Michael W. King della IU School of Medicine
| Controllo di autorità | BNE ( ES ) XX538926 (data) |
|---|


![{\ displaystyle V = {\ frac {V_ {max} [S]} {\ alpha K_ {m} + \ alpha ^ {\ prime} [S]}} = {\ frac {(1 / \ alpha ^ {\ prime}) V_ {max} [S]} {(\ alpha / \ alpha ^ {\ prime}) K_ {m} + [S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a8f0a9dda1d308de7f090f99c2833f944f11a09)
![{\ displaystyle \ alpha = 1 + {\ frac {[I]} {K_ {i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/57fcf54938a9784f9313437681b220079ff43ee5)
![{\ displaystyle \ alpha ^ {\ prime} = 1 + {\ frac {[I]} {K_ {i} ^ {\ prime}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8b7d75a61e059ecea4053a1c7afb91f9cf39a2ab)