Hidrocarburi
Hidrocarburile sunt compuși organici care conțin numai atomi de carbon și hidrogen . [1] [2]
Utilizate pe scară largă ca combustibili , sursa lor principală în natură este sursa fosilă .
Caracteristici
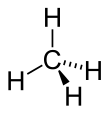
Atomii de carbon (C) sunt lipite împreună pentru a forma scheletul moleculei, în timp ce atomii de hidrogen (H) ies în afară din acest schelet. Hidrocarburile sunt singura clasă de compuși organici lipsiți de grupări funcționale , sunt compuși de fapt numai de atomi de hidrogen și carbon.
Pe măsură ce numărul de atomi de carbon în hidrocarburi lanțului crește, numărul de posibile hidrocarburi compuși crește. Cel mai scurt lanțul posibil este compus din doar un atom de carbon, care corespunde cu metan , având formula empirică CH 4.
Există trei hidrocarburi cu doi atomi de carbon:
Aceste trei hidrocarburi diferă prin numărul de legături care dețin cei doi atomi de carbon învecinați împreună: o legătură (așa vorbim de „simplă legătură“) , în cazul etanului, două legături ( „dublă legătură“) , în cazul etilenei și trei legături ( „triplă legătură“), în cazul acetilenei.
În structura unei hidrocarburi generic fiecare carbon atom utilizări de la unu la trei electroni de valență pentru a forma legături cu carbonul adiacent, în timp ce electronii de valență de carbon rămase sunt utilizate pentru a forma legături cu atomii de hidrogen. In interiorul moleculei de hidrocarburi poate fi vorba de atomii de carbon la care ei nu sunt atomi de hidrogen legați, dar numai alți atomi de carbon (de exemplu , este atomul de carbon central al moleculei neopentan ).
Clasificarea hidrocarburilor
O primă distincție între diferitele hidrocarburi se referă la lor starea fizică în condițiile de presiune și de temperatură a mediului și anume:
- Hidrocarburile solide sau semisolide: constituenți ai " asfalt , cu bitum și , ceară de parafină, etc ..
- Hidrocarbura lichide : constituenți de petrol (țiței), benzen , hexan , octan , etc.
- Hidrocarbonate gazelor : metan , etan , propan , butan , etc ..
Din punct de vedere al proprietăților chimice, hidrocarburile sunt împărțite în două clase principale:
- hidrocarburi aromatice : echipat cu „aromaticitate“, un proprietăți chimice conferită de un inel benzenic , ceea ce le face deosebit de stabil; [1]
- hidrocarburi alifatice : nu sunt echipate cu aromaticitate.
Diferitele tipuri de hidrocarburi (alcani, alchene, etc.) descrise mai jos sunt numite „serii omoloage“.
Clasificarea descrisă aici nu se intenționează a fi exhaustivă, de fapt , există mai multe tipuri de hidrocarburi care nu sunt bine clasificabile, cum ar fi , de exemplu, catenans , care sunt compuse din mai multe inele introduse una în cealaltă , astfel încât fiecare se poate mișca independent de celălalt , dar fără „topi“ (într - un mod similar cu inelele unui lanț de oțel, de unde și numele). [3]
hidrocarburi alifatice
În funcție de CC tipuri de obligațiuni prezintă în moleculă (single, duble sau triple) și geometria lor (liniar, ramificat, ciclic), hidrocarburi alifatice se împart în: [1]
- Hidrocarburi saturate cu numai CC obligațiuni unică [4]
- Alcani (sau parafine): hidrocarburi saturate non-ciclice, adică având un lanț nu reînchisă pe ea însăși; Ei au formula generală CnH2n + 2. La rândul lor, pot fi liniare sau ramificate, în funcție de faptul dacă atomii de carbon se succed în mod continuu sau cu bifurcatii
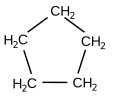
- cicloalcani : hidrocarburi saturate ciclice, având formula generală CnH2n [5]
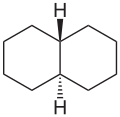
- bicicloalcani : hidrocarburi saturate constau din două catene ciclice învecinate [5]
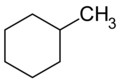
- alchilcicloalcani : hidrocarburi saturate constau dintr - un lanț de hidrocarbură ciclică legată de un lanț non-ciclic) [6]
Formula structura ciclopentan (a cicloalcani )
Formula structura decalină (a bicicloalcano )
Formula structura metilciclohexan (a alchilcicloalcano )
- hidrocarburi nesaturate conțin cel puțin o legătură multiplă CC (adică, dublu sau triplu) [4] . Legăturile formate din doi sau mai mulți atomi prezent în catena de carbon care constituie scheletul moleculei trigonal geometrie , deoarece Have ei sunt hibridizate sp 2 sau au o geometrie liniară , deoarece acestea sunt sp hibridizar; în scheletul moleculei există cel puțin o legătură dublă, σ + π;
- Alchene (sau olefine): non-ciclice și cu o legătură C = C dublă, având formula generală CnH2n
- diene (sau alcadienelor), trienes (sau alcatrieni), poliene : non-ciclice și având respectiv două, trei sau mai multe legături duble C = C
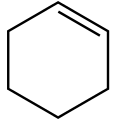
- cicloalchene : ciclic, cu o dublă C = C legătură, având formula generală CnH2n-2
- alchinele : non-ciclice și cu o triplă legătură C = C, având formula generală CnH2n-2
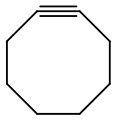
- cicloalchine : ciclic, cu o triplă legătură, având formula generală CnH2n-4.
Formula structura ciclohexenă (a cicloalchenă )
Formula structura cicloottino (a cicloalchino )
Hidrocarburile alifatice ciclice sunt numite hidrocarburi aciclice .
hidrocarburi aromatice
În funcție de tipul de structură, hidrocarburi aromatice pot fi împărțite în:
- benzen și derivații
- hidrocarburi aromatice policiclice (sau „policiclic“)
Structura Formula benzen (o hidrocarbură aromatică)
Structura Formula de cumen (un derivat de benzen)
Formula structurală a ' antracen (o polinucleato hidrocarbură aromatică)
Proprietate
În general , pentru alcanii aciclice, cei cu greutate moleculară similară au proprietăți chimice și fizice similare.
Ele există în natură diferite amestecuri de hidrocarburi, cu caratteristhe fizico-chimice intermediare de la o categorie la alta.
Stat de agregare

Starea de agregare hidrocarburilor (la temperatura ambiantă și presiunea) depinde de greutatea lor moleculară: hidrocarburi având o greutate moleculară mai mică ( de exemplu , metan , etan , propan ) pot fi găsite în stare gazoasă, cei cu greutate moleculară mai mare ( de exemplu , benzen , hexan și octan ) sunt lichide și cei având greutate moleculară mai mare sunt solide ceroase.
Adesea , hidrocarburile care temperatura și presiunea sunt sub formă de gaz sunt menținute în interiorul recipientelor sub presiune ( de exemplu buteliile ), astfel încât să le păstreze în volume mai mici. De fapt, la aceeași temperatură și cantitatea de substanță , așa cum crește presiunea, scade volumul ocupat de un gaz (așa cum a dedus din " drept gaz ideal sau alte ecuații de stat ), până când se trece (în parte sau în toto) la starea lichidă. De exemplu, comun „a buteliilor de gaz“ , utilizat într - un mediu casnic , care conține un amestec de hidrocarburi lichide (cunoscut sub numele de GPL ) , care sunt gazoase la temperatura și presiunea ambiantă.
Stabilitate / reactivitate
Hidrocarburi ciclice , care conțin mai puțin de șase atomi de carbon sunt în mod particular instabile datorită micimea inelului, ceea ce conduce la o înaltă tensiune inel (sau „tensiune unghiulară“), care este o înaltă energie stocată în molecula care tinde să deschidă inelul . [7]
În general, hidrocarburi saturate, cu toate că acestea sunt foarte inflamabile și astfel ușor reacționează cu " oxigenul , au o relativă inerția chimică; Din acest motiv , au fost numite parafine (de la latini affinis parum, „nereactiv“). [8]
Hidrocarburile care conțin nesaturări au alte proprietăți, datorită legături duble sau triple și sunt chimic mai reactive în pozițiile care conțin legături duble sau triple sau imediat adiacent acestora.
Hidrocarburi aromatice formează o clasă de propriile lor în ceea ce privește stabilitatea și au o reactivitate chimică foarte diferită de cea a hidrocarburilor alifatice.
Polaritate
Moleculele de alcani și cicloalcani sunt apolar , deoarece, chiar dacă CH legătură covalentă este polarizat, diferența de electronegativitate este destul de scăzut (0,4) și conduce structura tetraedrice la o distribuție a taxa în totalul moleculelor simetrice. Considerațiile în structura lor moleculară sunt confirmate prin teste de solubilitate : alcani sunt practic insolubile în apă , în timp ce se dizolvă în solvenți apolar.
Separarea hidrocarburilor
Multe hidrocarburi derivate din procesul de rafinare a petrolului , care constă dintr - un set de procese fizico-chimice , care au scopul obținerii anumitor produse chimice (amestecuri de combustibili, bitum, lubrifianți etc.) Pornind de la țiței .
Dintre diversele procese utilizate în rafinarea, distilarea țițeiului (sau „topping“) joacă un rol fundamental. În coloana de distilare uleiul brut este separat în mai multe „bucăți“, în funcție de greutatea moleculară (sau doresc să fie mai precisă, volatilitatea ) a hidrocarburilor care constituie tăietura în cauză. Fiecare tăietură este identificat prin numărul de atomi de carbon conținute în moleculele tăiate în cauză. De exemplu , tăietura C4 conține hidrocarburi care au patru atomi de carbon (cum ar fi butan , butenă și de izomeri ). Acest lucru se datorează faptului că este mult mai dificil de molecule de hidrocarburi separate, care au greutăți moleculare apropiate sau chiar identice, numai prin distilare. Aceasta reflectă faptul că hidrocarburile similare ( de exemplu , aparținând aceleiași serii omoloage ) au proprietăți chimice-fizice similare între ele.
Procese chimice care implică hidrocarburi
Hidrocarburile sunt o astfel de clasă largă de compuși, care este imposibil să se numească toate reacțiile industriale în care acestea pot fi implicate.
Printre numeroasele reacții ce implică hidrocarburi, sunt incluse următoarele:
- cracare : este un proces chimic industrial adresat la formarea parafinelor cu greutate moleculară mică din parafinelor cu greutate moleculară ridicată;
- reformare catalitică este un proces care are ca scop obținerea unui produs cu o cifră octanică mai mare. Pornind de la parafine, olefine, aromatice, izomerii ramificați și molecule cu catenă mai scurte sunt formate;
- polimerizare : este exploatată pentru obținerea de polimeri , sau molecule având greutăți moleculare foarte ridicate; polimeri de natură de hidrocarburi sunt , cum ar fi polietilena și polipropilena .
Aspecte economice și geopolitice
Toate hidrocarburi capătă o importanță enormă în " economie și geopolitică modernă, în primul rând datorită rolului lor esențial ca o sursă de energie și pentru marea aplicațiile industriale .
Notă
Bibliografie
- TW Graham Solomons, Organic Chemistry , editat de G. Ortaggi, D. Misti, ediția a II-a, Bologna, Zanichelli, 1988, ISBN 88-08-09414-6 .
- (EN) William D. Callister, Știința și ingineria materialelor: o introducere , ediția a 5-a, John Wiley & Sons Inc., 1999, ISBN 0-471-35243-8 .
Elemente conexe
- Petrol
- Combustibili fosili
- Gaz natural
- Compusi organici
- Originea abiotică a uleiului
- aragaz hidrocarbonat
- Polimer
Alte proiecte
-
 Wikționar conține dicționar de intrare „ hidrocarburi “
Wikționar conține dicționar de intrare „ hidrocarburi “ -
 Wikimedia Commons conține imagini sau alte fișiere pe hidrocarburi
Wikimedia Commons conține imagini sau alte fișiere pe hidrocarburi
linkuri externe
- (RO) Hidrocarburi , în Enciclopedia Britannica , Encyclopaedia Britannica, Inc.
- Cazarea și structura hidrocarburilor (PDF) [ link rupt ] , pe treccani.it .
- MSN Encarta - Hidrocarburi , pe it.encarta.msn.com. Accesat 25 octombrie 2009 (depusă de „URL - ul original 23 mai 2009).
- Sapere.it - Hidrocarburi , pe sapere.it.
- (RO) Structurile moleculare ale Compuși organici - Hidrocarburi , pe csi.chemie.tu-darmstadt.de.
| Controlul autorității | Thesaurus BNCF 12924 · LCCN (RO) sh85063372 · GND (DE) 4125165-9 · BNF (FR) cb119369263 (data) · NDL (RO, JA) 00572658 |
|---|