boala Addison
Această intrare sau secțiune despre subiectul bolilor nu menționează sursele necesare sau cei prezenți sunt insuficienți . |
| boala Addison | |
|---|---|
| Hiperpigmentare găsită în boala Addison | |
| Specialitate | endocrinologie |
| Clasificare și resurse externe (EN) | |
| OMIM | 103230 și 240200 |
| Plasă | D000224 |
| MedlinePlus | 000378 |
| eMedicină | 116467 |
| Eponime | |
| Thomas Addison | |
Boala Addison (adesea numită și boala Addison [1] sau insuficiență suprarenală cronică , hipocortizolism , hipoadrenalism ) este forma principală a insuficienței cronice suprarenale care rezultă dintr-o reducere severă, permanentă și ireversibilă, a creșterii hormonilor prelucrați de cortexul suprarenal . Prin urmare, este o boală cronică a sistemului endocrin caracterizată printr-o serie de simptome relativ nespecifice, cum ar fi durerea și slăbiciunea abdominală , dar în anumite circumstanțe, acestea pot evolua în atacuri acute severe care pot duce la hipotensiune arterială severă și comă .
Afecțiunea rezultă din problemele glandei suprarenale care pot fi cauzate de o defecțiune a sistemului imunitar , anumite infecții sau diferite cauze mai rare. Boala Addison este, de asemenea, cunoscută sub numele de insuficiență suprarenală cronică primară, pentru a o deosebi de insuficiența suprarenală acută primară, adesea cauzată de sindromul Waterhouse-Friderichsen . Boala Addison ar trebui, de asemenea, să se distingă de insuficiența suprarenală secundară și terțiară, care sunt cauzate de lipsa de ACTH (produsă de hipofiză ) și respectiv de CRH (produsă de hipotalamus ). În ciuda acestei distincții, crizele addisoniene pot apărea în toate formele de insuficiență suprarenală.
Boala Addison și alte forme de hipoadrenalism sunt de obicei diagnosticate cu teste de sânge și tehnici de imagistică medicală . [2] Tratamentul constă în înlocuirea hormonilor absenți (datorită hidrocortizonului oral și fludrocortizonului ). Este necesară menținerea continuă a terapiei de substituție a steroizilor, cu urmărire constantă și monitorizare a altor probleme de sănătate. [2]
Condiția poartă numele lui Thomas Addison , absolvent al Colegiului Medical din Edinburgh , care a descris prima dată afecțiunea în 1849. Adjectivul „Addisonian” este folosit pentru a descrie caracteristicile afecțiunii, precum și pacienții cu boala. [2]
Istorie
Boala Addison poartă numele lui Thomas Addison , medicul britanic care a descris prima dată afecțiunea în publicația din 1855 privind efectele constituționale și locale ale bolilor capsulelor suprarenale . [3] El a descris-o inițial ca „melasma suprarenală”, dar comunitatea științifică i-a dat ulterior omonimul „boala Addison” ca recunoaștere a descoperirii lui Addison. [4]
Toți cei șase pacienți inițiali ai lui Addison aveau tuberculoză suprarenală, [5] în timp ce cei șase din 1855 aveau tuberculoză suprarenală; termenul „boala Addison” nu implică un proces de boală de bază.
Condiția a fost considerată inițial o formă de anemie asociată cu glandele suprarenale. De vreme ce se știau puține despre glandele suprarenale (numite pe atunci „capsule suprarenale ”), monografia lui Addison care descrie starea a fost o perspectivă izolată. Pe măsură ce funcția suprarenală a devenit mai cunoscută, studiul lui Addison a devenit cunoscut ca o contribuție științifică importantă și un exemplu clasic de observație medicală atentă. [6]
Epidemiologie
Incidența bolii Addison în populația umană este estimată la aproximativ 1 din 100.000 de persoane. [7] Cu toate acestea, unii cercetători au propus valori mai mari, variind de la 40 la 144 de cazuri pe milion de populație (1 din 25.000 și, respectiv, 1 din 7.000). [8] [9] Condiția poate afecta persoanele de orice vârstă, sex sau etnie , dar apare de obicei la adulți cu vârsta cuprinsă între 30 și 50 de ani. [10] Studiile epidemiologice nu au arătat predispoziții semnificative bazate pe etnie. [9]
Etiologie
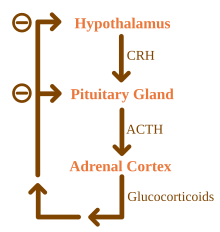
Cauzele bolii Addison pot fi clasificate în funcție de mecanismul care implică producția insuficientă de cortizol de către glandele suprarenale. Poate fi disgeneză suprarenală (glanda nu s-a format în mod adecvat în timpul dezvoltării), steroidogeneza afectată (glanda este prezentă dar este incapabilă din punct de vedere biochimic să producă cortizol) sau procesele patologice ulterioare care duc la distrugerea aproape completă a cortexului suprarenal. [2]
În cele din urmă, afecțiunea se poate dezvolta după adrenalectomia bilaterală la pacienții cu forme deosebit de severe de boală Cushing .
Distrugerea glandei suprarenale
Aproximativ 70% din cazurile de boală Addison se datorează agresiunii autoimune a glandei (atrofie suprarenală autoimună sau atrofie idiopatică a cortexului suprarenal). Această formă a bolii Addison se caracterizează printr-un infiltrat limfomonocitar ( adrenalită ) a cortexului suprarenal. În circulație există ACA ( anticorpi anti-cortex ) direcționați către 21 hidroxilază, enzima cheie a steroidogenezei . Acești anticorpi sunt foarte specifici și pot fi ocazional găsiți și la pacienții cu boală Graves sau tiroidită Hashimoto, iar prezența lor indică riscul apariției insuficienței suprarenale. Detectarea acestor anticorpi poate preceda apariția insuficienței suprarenale manifeste cu ani de zile. Prima țintă pare a fi zona glomerulară producătoare de aldosteron ; de fapt, la început, se observă o creștere a activității reninei serice. Anticorpii după distrugerea glandei suprarenale și, prin urmare, apariția simptomelor clinice dispar.
În lumea industrializată, suprarenalita autoimună este cea mai frecventă cauză a bolii Addison. Distrugerea autoimună a cortexului suprarenal se datorează unei reacții imune declanșate împotriva enzimei steroidiene 21-monooxigenază (fenomen descris pentru prima dată în 1992). [11] Această enzimă poate fi izolată în contextul sindromului polendocrin autoimun (tip 1 sau 2) în care pot fi implicate și organe producătoare de hormoni suplimentari, cum ar fi tiroida și pancreasul . [12]
Distrugerea glandei suprarenale este, de asemenea, o caracteristică a adrenoleucodistrofiei , prezența metastazelor (răspândirea celulelor canceroase din alte părți ale corpului, în special din plămâni ) în glandele suprarenale, apariția sângerărilor (de exemplu în Waterhouse-Friderichsen sindromului , infarctelor suprarenale sau sindromului anticorpilor antifosfolipidici ), în cazul anumitor infecții (cum ar fi tuberculoza , histoplasmoza , coccidiomicoza , SIDA ) sau cu depunerea de proteine anormale în caz de amiloidoză . [13]
Disgenezie suprarenală
Toate cauzele din această categorie sunt de origine genetică și se găsesc în general foarte rar. Acestea pot include mutații în factorul de transcripție SF1 , hipoplazie suprarenală congenitală (datorită mutațiilor genei DAX-1) și mutații în gena receptorului ACTH (sau genele înrudite, ca în sindromul tripa A ). Mutațiile genei DAX-1 se pot grupa într-un sindrom de deficit de glicerol kinază care este asociat cu o serie de alte simptome suplimentare care apar atunci când acea genă este ștearsă împreună cu altele. [2]
Printre cauzele minore ne amintim și de hipoplazia congenitală a suprarenalelor, o boală ereditară caracterizată prin lipsa de reacție a celulelor suprarenale la ACTH și boala Addison de origine iatrogenă, de la suprarenalectomia bilaterală, la pacienții cu forme deosebit de severe de boală Cushing . .
Steroidogeneza afectată
Pentru sinteza cortizolului , glanda suprarenală are nevoie de colesterol, care este apoi transformat biochimic în hormoni steroizi . Printre bolile care implică întreruperea alimentării cu colesterol se numără sindromul Smith-Lemli-Opitz și abetalipoproteinemia .
Dintre problemele de sinteză, hiperplazia suprarenală congenitală este cea mai frecventă (sub diferite forme: 21-hidroxilază, 17α-hidroxilază, 11β-hidroxilază și 3β-hidroxisterid dehidrogenază), lipidă CAH datorită deficienței mutațiilor STAR și a ADN-ului mitocondrial. [2] În cazuri rare, boala Addison poate fi iatrogenă , de fapt unele medicamente interferează cu enzimele de sinteză a steroizilor (de exemplu, ketoconazolul ), în timp ce altele accelerează defalcarea normală a hormonilor de către ficat (de exemplu, rifampicină , fenitoină ). [2]
Fiziopatologie
Deficitul de aldosteron și cortizol este responsabil pentru cele mai grave manifestări ale bolii Addison, în timp ce deficitul de androgeni suprarenali este responsabil doar pentru reducerea sistemului de păr la femei, în special la nivel axilar.
Lipsa aldosteronului determină o capacitate redusă de a reține sodiul (deci și de apă) și de a elimina potasiul din tubulii renali, prin urmare în boala Addison există o creștere a excreției de sodiu și o scădere a excreției de potasiu în urină care este diluată: aceasta are ca rezultat concentrații scăzute de sodiu și clor în sânge și o concentrație serică ridicată de potasiu. Incapacitatea de a concentra urina, asociată cu modificări ale echilibrului electrolitic, duce la deshidratare severă, hipertonicitate plasmatică, acidoză, hipovolemie , scădere în greutate, hipotensiune, scăderea debitului cardiac, astenie intensă și debut ușor al episoadelor lipotimice de hipotensiune ortostatică. În plus, hiperkaliemia indusă de deficitul de aldosteron poate fi responsabil pentru tulburări de ritm (asistolă, blocuri AV etc.).
Acidul gliciretic posedă o moleculă cu o structură similară cu cea a aldosteronului (afinitate scăzută, dar definită, necesitând, prin urmare, doze mari pentru a avea o activitate biologică), un mecanism de acțiune și simptome similare (atât de mult încât hipokaliemia de lemn dulce a fost una dintre cele mai frecvente cauze ale hipertensiunii arteriale în țările în care disponibilitatea acesteia nu a fost limitată), o „competiție” directă a acidului gliciretic-aldosteron care a permis pacienților cu boala Addison să supraviețuiască doar luând doze mari de rădăcini de lemn dulce: deficitul de aldosteron a crescut potasiul și a pierdut apa și sodiu, în timp ce lemnul dulce a funcționat în sens opus [14] [15] .
Deficitul de cortizol contribuie la hipotensiune și provoacă tulburări metabolice, cum ar fi gliconeogeneza redusă, scăderea glicogenului hepatic, scăderea mobilizării și utilizării grăsimilor , a hipoglicemiei care împreună cu hiponatremia sunt responsabile pentru astenia intensă și pierderea în greutate care caracterizează pacienții addisonieni. Modificările metabolice sunt, de asemenea, considerate responsabile pentru tulburările psihice care sunt detectabile clinic la aproximativ 70% dintre acești pacienți și care constau în principal din apatie, interes redus pentru mediu, depresie . Cortizolul exercită în mod normal o acțiune stimulatoare asupra eritropoiezei și influențează traficul leucocitelor între compartimentul intravascular și țesuturi, inducând o creștere a granulocitelor și o scădere a limfocitelor și eozinofilelor , deficitul său determină modificări în direcția opusă a elementelor sanguine cu anemie , neutropenie, limfocitoză și eozinofilie. Reducerea nivelului sanguin al cortizolului duce la hipersecreția ACTH pituitară și a peptidelor conexe, cum ar fi beta-lipotropina, alfa și beta-MSH, care au activitate de stimulare a melanocitelor și produc hiperpigmentare a pielii și a mucoasei caracteristice bolii Addison. Cea mai gravă consecință a lipsei de cortizol este reprezentată totuși de incapacitatea pacienților addisonieni de a răspunde în mod adecvat la orice tip de stres fiziologic și patologic, acești subiecți fiind extrem de fragili în fața evenimentelor morbide, traume, intervenții chirurgicale care sunt ușor de depășit. de către subiecți normali.
Tablou clinic
În forma completă, boala se exprimă simptomatologic cu o triadă caracteristică: astenie, melanodermie, hipotensiune. Progresia bolii este lentă și treptată în raport cu progresia leziunilor distructive ale glandei. Când pierderea țesutului suprarenalian depășește 90%, există o imagine completă a insuficienței suprarenale cronice. Principalele simptome și semne sunt:
- astenia , hipoglicemia , oboseala și hipotensiunea ortostatică sunt simptome timpurii, la început astenia apare după o perioadă de stres, în timp ce ulterior pacientul este obligat să rămână în pat. La fel ca astenia, anorexia și pierderea în greutate sunt elemente clinice prezente în mod constant în Addison, atât de mult încât este puțin probabil un astfel de diagnostic la un pacient care se bucură de un apetit bun sau care are creștere în greutate sau care denunță o bună vigoare fizică.
- Acanthosis nigricans și melanoderma , adică hiperpigmentarea pielii, sunt a doua manifestare cardinală a bolii și se datorează hipersecreției de ACTH , un hormon care derivă din același precursor al MSH (hormon care stimulează melanocitele). Acest precursor se numește proopiomelanocortină (POMC). Hiperpigmentarea în stadiile incipiente este ușoară și poate fi confundată cu reziduurile dintr-un bronz sau cu un ton natural al pielii maro. Unele caracteristici ale hiperpigmentării addisoniene îi permit să se distingă de alte forme: este mai evidentă în pliurile pielii (în special în pliurile palmelor mâinilor), în zonele expuse la presiune sau frecare continuă (ca în sulcul inframamar la femeile care poartă sutienul, sau la guler, centura pantalonilor, coatele și genunchii) și în toate regiunile normal hiperpigmentate (cum ar fi areolele mamare, regiunea scrotală și perineală) și încă în locul cicatricilor produse după debutul bolii . Mai mult, în boala Addison, hiperpigmentarea se extinde și la nivelul membranelor mucoase, dintre care cele mai frecvent afectate sunt mucoasa bucală în corespondență cu obrajii, gingiile, palatul, mucoasa vaginală și mucoasa rectală. Asocierea dintre melanodermia cutanată și hiperpigmentarea mucoasei este puternic sugestivă pentru natura addisoniană a deviațiilor pigmentare. Cu toate acestea, trebuie adăugat că între zonele de hiperpigmentare a pielii pot exista pete de hipopigmentare care pot ajunge până la vitiligo . Pielea este deosebit de uscată din cauza deshidratării din cauza epuizării sodiului.
- Amețeli și atacuri sincopale sunt deseori prezente
- tulburări neuropsihice, cum ar fi iritabilitate, anxietate și apatie , precum și dificultăți de concentrare
- dureri abdominale, în special în regiunea epigastrică cu greață , vărsături și diaree (diagnostic diferențial cu ulcer peptic )
- modificările funcției sexuale sunt destul de frecvente, amenoreea , cea mai frecventă dintre ele, poate fi consecința pierderii în greutate la care suferă pacientul addisonian sau exprimă concomitența unei insuficiențe gonadale primitive cu geneza autoimună. Pierderea părului pubian și axilar la femei exprimă secreția redusă a androgenilor suprarenali.
Criza suprarenală
Prin „criză suprarenală” sau „criză addisoniană” înțelegem o serie de simptome care indică insuficiență suprarenală severă. Acest lucru poate apărea ca urmare a bolii Addison nediagnosticate anterior, a unui proces de boală care afectează brusc funcția suprarenală (de exemplu, sângerarea suprarenală) sau a unei probleme intercurente (de exemplu, o infecție sau traume) la cineva despre care se știe că are boala Addison. Aceasta este o urgență medicală și o situație care poate pune viața în pericol, care necesită tratament imediat de urgență.
Simptomele caracteristice sunt: durere bruscă și străpungătoare a picioarelor, a spatelui inferior sau a abdomenului, vărsături intense și diaree care duc la deshidratare. tensiune arterială scăzută , sincopă (pierderea conștienței și capacității de a sta în picioare), hipoglicemie (nivel scăzut al glicemiei ), psihoză , confuzie mentală , letargie severă, hiponatremie (nivel scăzut de sodiu din sânge), hiperkaliemie (nivel ridicat de zahăr din sânge ) potasiu în sânge ), hipercalcemie (nivel ridicat de calciu în sânge), convulsii , febră . [16]
Teste de laborator
Unele sunt foarte nespecifice, cum ar fi anemia normocitară cu limfocitoză și eozinofilie, mai semnificative sunt unele modificări ale chimiei sângelui, cum ar fi:
- hiponatremie (<130 mEq / L), epuizarea sodiului înseamnă epuizarea apei, care la rândul său duce la hipovolemie și hipotensiune
- hiperkaliemie (> 5 mEq / L), responsabilă de aritmii hipokinetice și acidoză metabolică
- hipoglicemie
- creșterea ureei plasmatice și a creatininei din sânge datorită unui mecanism prerenal care depinde de hipovolemie. Contracția volumului poate fi astfel încât să inducă o reducere a filtratului glomerular și, prin urmare, o creștere a deșeurilor azotate. Imaginea azotemiei prerenale regresează imediat ce alimentarea cu apă a corpului este reintegrată.
- nivelurile de renină plasmatică și ACTH au crescut.
NB: când insuficiența adrenocorticală este cauzată de o producție inadecvată de ACTH hipofizară, nivelurile de electroliți sunt normale și nu există melanodermie (așa-numita „White Addison”).
- ECG poate prezenta o încetinire generalizată a ritmului, tensiuni scăzute și prelungirea intervalelor PR și QT.
Diagnostic
Diagnosticul este suspectat pe baza simptomelor și semnelor și confirmat prin teste de laborator. Insuficiența suprarenocorticală poate fi diagnosticată prin demonstrarea incapacității de a crește nivelul plasmatic de cortizol sau excreția urinară de cortizol liber după administrarea ACTH.
Testul de evaluare a insuficienței adrenocorticale: Testul se efectuează prin injectarea a 250 micrograme de ACTH sintetic (Cortrosyn) IV. Înainte de injecție, cortizolul plasmatic normal este între 5 și 25 micrograme / dL (între 138 și 690 nmol / L) și se dublează între 30 și 90 de minute, cu un minim de 20 micrograme / dL (552 nmol / L). Pacienții cu boala Addison au valori scăzute sau normale, care nu cresc.
Distincția între insuficiența suprarenală primară și secundară: Majoritatea cazurilor de insuficiență hipo- suprarenală secundară sunt cauzate de distrugerea glandei pituitare. Prin urmare, CT sau RMN-ul șeii poate fi util în excluderea prezenței tumorilor sau a atrofiei. La pacienții cu boală suprarenală primară, nivelul plasmatic de ACTH este crescut (> 50 pg / ml). Pacienții cu insuficiență hipofizară sau deficit de ACTH izolat au un nivel scăzut al hormonului. Dacă se suspectează insuficiență suprarenală secundară, acest lucru poate fi confirmat prin teste cu metyrapone. Metyrapone este un medicament capabil să blocheze enzima 11-b-hidroxilază, prin urmare, deprimă conversia 11-deoxicortizolului în cortizol, ale cărui niveluri plasmatice sunt reduse cu o creștere a secreției de ACTH.
Acesta din urmă stimulează steroidogeneza suprarenală, care determină o acumulare de 11-b-hidroxicortizol, steroidul care precede imediat stadiul blocat enzimatic. Deoarece 11-deoxicortizolul este metabolizat și excretat sub formă de 17-OHCS, excreția urinară a acestor steroizi va fi îmbunătățită semnificativ prin administrarea de metyrapone. Cea mai bună și mai simplă metodă este de a administra 30 mg / kg metyrapone po împreună cu o cantitate mică de alimente la miezul nopții pentru a evita iritarea gastrică. Cortizolul plasmatic la 8 dimineața următoare dimineața trebuie să fie <10 micrograme / dL (<276 nmol / L), iar 11-deoxicortizolul plasmatic trebuie să fie între 7 și 22 micrograme / dL (0,2 până la 0,6 mmol / L). La pacienții care nu răspund la metyrapone, trebuie efectuat un test ACTH. Pacienții cu insuficiență adrenocorticală primară au niveluri scăzute de ambii steroizi și nu răspund la ACTH; cei cu hipopituitarism răspund la ACTH, dar nu metyrapone.
Hipoadrenalismul acut sau criza suprarenală acută este o afecțiune de urgență medicală caracterizată prin apariția bruscă a unui șoc care se înrăutățește rapid, aceasta poate apărea ca urmare a erorilor alimentare (alimente bogate în potasiu , diete cu conținut scăzut de sare ) sau mai des datorate întreruperii sau întârzierii inițierea terapiei de substituție cu corticosteroizi sau, în cele din urmă, în timpul unui eveniment stresant, cum ar fi o infecție , traume , intervenții chirurgicale care afectează o persoană care suferă de o insuficiență adrenocorticală nerecunoscută și până în acel moment în echilibru labil sau la un pacient în terapia de substituție, creșterea dozei de corticosteroizi impusă de debutul stresului nu a fost asigurată .
Cele mai grave forme de insuficiență adrenocorticală acută rezultă din distrugerea bruscă, completă și ireversibilă a glandei cauzată de hemoragii suprarenale masive în cursul sepsisului , leucemie acută, terapie anticoagulantă masivă, tromboză a venei centrale . Sepsisul meningococic ( sindromul Waterhouse-Friderichsen ) este cea mai frecventă cauză a insuficienței suprarenale acute la copii. Tabloul clinic apare acut, adesea sub formă explozivă, și se caracterizează prin: astenie profundă, durere abdominală violentă la locul epigastric, frecvent însoțită de vărsături și diaree abundentă (până la suspiciunea unui diagnostic eronat de gastroenterită acută sau sugerarea ipoteza unui abdomen acut), colaps vascular periferic și, în cele din urmă, insuficiență renală acută cu azotemie. Temperatura corpului poate fi sub normal, deși se observă adesea hipertermie severă datorată infecțiilor. În sindromul Waterhouse-Friderichsen, infecția este însoțită de manifestări hemoragice difuze care, pe lângă glanda suprarenală, afectează pielea ( purpura fulminans ), creierul , viscerele.
Unele elemente sunt denumite în mod obișnuit distincte ale șocului hipoadrenal: deshidratare marcată, tendință la hipoglicemie , hiperkaliemie și hiponatremie , reducere extremă a ratei cortizolului din sânge. În practică, aceste date au o valoare diagnostic limitată, deoarece evoluția hipoadrenalismului acut este atât de rapidă și tumultuoasă încât etapele principale ale procesului de diagnostic nu pot fi realizate. Prin urmare, diagnosticul este fundamental clinic. Posibilitatea insuficienței suprarenale acute trebuie luată în considerare la fiecare pacient care se prăbușește și dacă un element anamnestic și obiectiv chiar vag susține suspiciunea noastră (terapia anterioară cu steroizi, debut în cursul unei sepsis sau după un traumatism abdominal sau lombar sever) este recomandabil să începeți imediat terapia, administrând doze masive de corticosteroizi și completând pierderea de sodiu cu perfuzii izotonice de NaCl.
Tratament
Prognoză
În general, prognosticul bolii Addison este bun dacă starea este tratată corespunzător. Majoritatea pacienților se pot aștepta să ducă o viață relativ normală. Persoanele cu boală ar trebui să acorde atenție simptomelor unei „crize a lui Addison” atunci când se află într-un moment stresant, cum ar fi în timpul exercițiilor fizice, unde ar avea nevoie de tratament de urgență cu injecții intravenoase pentru a gestiona situația. [17]
Persoanele cu boala Addison au o rată a mortalității mai mult decât dublată. [18] În plus, cei care au și diabet zaharat au o creștere de aproape 4 ori a mortalității comparativ cu persoanele cu diabet zaharat. [19]
La alte animale
Cazurile bolii se găsesc și la câini: este o formă extrem de rară care afectează 1 din 10 milioane de câini.
Notă
- ^ Termenul de boală, din latinescul mòrbus , „boală care duce la moarte”, a fost folosit istoric pentru a indica boli cu un curs fatal , mai ales pentru că sunt necunoscute și, prin urmare, incurabile. În prezent, este un termen în curs de a fi abandonat atât din respect pentru pacient, cât și pentru că s-a constatat originea și vindecarea multor boli.
- ^ a b c d e f g Ten S, New M, Maclaren N, Clinical review 130: Addison's disease 2001 , în The Journal of Clinical Endocrinology and Metabolism , vol. 86, nr. 7, 2001, pp. 2909-2922, DOI : 10.1210 / jc.86.7.2909 , PMID 11443143 .
- ^ Thomas Addison , Despre efectele constituționale și locale ale bolilor capsulelor suprarenale, Londra, Samuel Highley, 1855 ( arhivat la 14 aprilie 2005) .
- ^ (EN) Medic și chirurg , Keating & Bryant, 1885.
- ^ Patnaik MM, Deshpande AK,Diagnostic - Boala Addison secundară tuberculozei glandelor suprarenale , în Clinical Medicine & Research , vol. 6, nr. 1, mai 2008, p. 29, DOI : 10.3121 / cmr . 2007.754a , PMC 2442022 , PMID 18591375 .
- ^ Bishop PM,Istoria descoperirii bolii Addison , în Proceedings of the Royal Society of Medicine , vol. 43, nr. 1, 1950, pp. 35-42, DOI : 10.1177 / 003591575004300105 , PMC 2081266 , PMID 15409948 .
- ^ Boala Addison , a medicinenet.com , MedicineNet. Adus la 25 iulie 2007 ( arhivat la 24 iunie 2007) .
- ^ Insuficiență suprarenală și boala Addison , la niddk.nih.gov , Institutul Național de Diabet și Boli Digestive și Rinice , mai 2014. Accesat pe 13 martie 2016 ( arhivat pe 13 martie 2016) .
- ^ a b Sylvester Odeke, boala Addison , emedicine.com , eMedicine . Adus la 25 iulie 2007 ( arhivat la 7 iulie 2007) .
- ^ Robert Volpé, Boli autoimune ale sistemului endocrin , CRC Press, 1990, pp.299 , ISBN 978-0-8493-6849-3 .
- ^ Winqvist O, Karlsson FA, Kämpe O, 21-Hydroxylase, un autoantigen major în boala Addison idiopatică , în The Lancet , vol. 339, nr. 8809, iunie 1992, pp. 1559-62, DOI : 10.1016 / 0140-6736 (92) 91829-W , PMID 1351548 .
- ^ Husebye ES, Perheentupa J, Rautemaa R, Kämpe O, Manifestări clinice și managementul pacienților cu sindrom poliandocrin autoimun tip I , în Journal of Internal Medicine , vol. 265, nr. 5, mai 2009, pp. 514-29, DOI : 10.1111 / j.1365-2796.2009.02090.x , PMID 19382991 .
- ^ Ron Kennedy, Addison's Disease , su medical-library.net , The Doctors' Medical Library. URL consultato il 10 aprile 2013 (archiviato dall' url originale il 12 aprile 2013) .
- ^ Binding of glycyrrhetinic acid to kidney mineralocorticoid and glucocorticoid receptors. , Ulmann A, Menard J, Corvol P, in Endocrinology, 1975 Jul;97(1):46-51
- ^ Effect of Aldosterone and Glycyrrhetinic Acid on the Protein Expression of PAI-1 and p22phox in Human Mononuclear Leukocytes , Armanini et al, JCEM Calò et al. 89 (4): 1973
- ^ Addison's Disease , su endocrine.niddk.nih.gov , National Endocrine and Metabolic Diseases Information Service. URL consultato il 26 ottobre 2007 ( archiviato il 28 ottobre 2007) .
- ^ Addison's disease - Treatment , su nhs.uk , NHS Choices. URL consultato l'8 ottobre 2016 ( archiviato il 9 ottobre 2016) .
- ^ Ragnhildur Bergthorsdottir, Maria Leonsson-Zachrisson, Anders Odén e Gudmundur Johannsson, Premature Mortality in Patients with Addison's Disease: A Population-Based Study , in The Journal of Clinical Endocrinology & Metabolism , vol. 91, n. 12, 1º dicembre 2006, pp. 4849-4853, DOI : 10.1210/jc.2006-0076 , ISSN 0021-972X , PMID 16968806 .
- ^ Dimitrios Chantzichristos, Anders Persson, Björn Eliasson, Mervete Miftaraj, Stefan Franzén, Ragnhildur Bergthorsdottir, Soffia Gudbjörnsdottir, Ann-Marie Svensson e Gudmundur Johannsson, Cushing Syndrome and Primary Adrenal Disorders , Meeting Abstracts, Endocrine Society, 1º aprile 2016, pp. OR25–4–OR25–4, DOI : 10.1210/endo-meetings.2016.ahpaa.9.or25-4 . URL consultato il 20 gennaio 2020 (archiviato dall' url originale il 17 dicembre 2019) .
Bibliografia
- ( EN ) Robert Volpé, Autoimmune Diseases of the Endocrine System , CRC Press, 1990, ISBN 978-0-8493-6849-3 .
Voci correlate
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su malattia di Addison
Wikimedia Commons contiene immagini o altri file su malattia di Addison
Collegamenti esterni
- Malattia di Addison , su sapere.it , De Agostini .
- ( EN ) Malattia di Addison , su Enciclopedia Britannica , Encyclopædia Britannica, Inc.
- Sito dell'Associazione di Pazienti di Addison AIPAd , su morbodiaddison.org .
| Classificazione e risorse esterne ( EN ) | ICD-9-CM :255.41 ; ICD-10-CM : E27.1 ; OMIM : 103230 e 240200 ; MeSH : D000224 ; DiseasesDB : 222 ; MedlinePlus : 000378 ; eMedicine : 116467 ; |
| Controllo di autorità | Thesaurus BNCF 21285 · LCCN ( EN ) sh85000815 · BNF ( FR ) cb124303775 (data) · BNE ( ES ) XX529072 (data) |
|---|

