Alchene
Alchenele sunt hidrocarburi (adică, compușii organici constau numai din atomi de carbon și hidrogen ) aciclici conținând exact o dublă legătură C = C. [1] Alchenele aparțin clasei olefinelor , căreia îi aparțin și cicloalcenele și polienele . [2]
Au o formulă brută C n H 2n . [1]
Cel mai simplu alchena existent este etilena (sau etenă), având formula CH2 = CH2, din care polietilenă se obține prin polimerizare de adiție .
| Nume | Formulă moleculară | Numărul de atomi de carbon | Masă molară | numar CAS | Formula structurala |
|---|---|---|---|---|---|
| Etilenă (sau etenă) | C 2 H 4 | 2 | 28,054 g / mol | 74-85-1 |  |
| Propilenă (sau propenă) | C 3 H 6 | 3 | 42,08 g / mol | 115-07-1 |  |
| 1- Butilenă (sau 1-butenă) | C 4 H 8 | 4 | 56,11 g / mol | 106-98-9 | 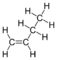 |
| 1- Penten | C 5 H 10 | 5 | 70,13 g / mol | 109-67-1 | 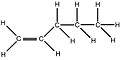 |
Ca și în cazul alcanilor , atomii de carbon sunt uniți prin legături covalente pentru a forma un lanț deschis, liniar sau ramificat; cu toate acestea, o pereche de atomi de carbon adiacenți este unită printr-o legătură covalentă dublă.
Cei doi atomi de carbon implicați în dubla legătură au orbitali hibrizi sp 2 ; acest lucru face ca cei trei atomi legați de fiecare dintre ei să se afle la cele trei vârfuri ale unui triunghi aproximativ echilateral. Cele două triunghiuri sunt, de asemenea, aliniate de-a lungul axei legăturii și coplanare între ele.
O legătură CC este de tip σ , formată prin suprapunerea a doi orbitali hibrizi sp 2 de -a lungul axei legăturii; cea de-a doua legătură este de tip π , formată prin suprapunere într-o direcție perpendiculară pe axa legăturii celor doi orbitali p care nu sunt implicați în hibridizare .
Spre deosebire de ceea ce se întâmplă în alcani , rotația în jurul legăturii duble este împiedicată. Aceasta, când fiecare dintre carbonii implicați în legătura dublă are substituenți diferiți, creează perechi de izomeri geometrici , care se disting între ei prin prefixele „cis-” și „trans-” (vezi formula chimică ).
Prezența dublei legături carbon-carbon conferă alchenelor o reactivitate mai mare decât cea a alcanilor corespunzători. Această reactivitate se exprimă în principal prin reacții suplimentare, care implică deschiderea legăturii duble și conversia acesteia în două legături simple. Adăugarea unei molecule de alchenă la alta identică, repetată practic la infinit, produce un exemplu de polimer .
Nomenclatura IUPAC
Nomenclatura IUPAC a alchenelor urmează reguli similare cu cea a alcanilor , cu toate acestea ar trebui remarcate unele diferențe:
- la identificarea lanțului principal al moleculei, aceasta trebuie să includă cei doi atomi de carbon implicați în dubla legătură.
- denumirea dată lanțului principal este similară cu cea prevăzută pentru alcani, dar sufixul -ane este înlocuit cu sufixul -ene (etenă, propenă, butenă, pentenă, hexenă, heptenă, octenă etc ...)
- în numerotarea lanțului principal, trebuie atribuit cel mai mic număr posibil celor doi atomi de carbon implicați în dubla legătură.
- când fiecare dintre cei doi atomi implicați în legătura dublă are doi substituenți diferiți legați de aceasta, alchena prezintă izomerism geometric. Pentru a distinge cei doi izomeri, se folosesc prefixele cis- , atunci când cei doi substituenți voluminoși ai fiecărui atom sunt pe aceeași parte a legăturii duble și trans- , când cei doi substituenți voluminoși ai fiecărui atom sunt pe laturile opuse ale dublei legătură. (Exemple de pagini cu izomerie și formulă chimică ).
Surse industriale
Cele două procese industriale principale de producție a alchenelor sunt patul fluid al catalizatorului de cracare (FCC, Fluid Catalytic Cracking) și cracarea cu abur . Primul este un proces de rafinărie, al doilea este un proces petrochimic și produce în esență etilenă și propilenă . Prepararea 1-alchenelor liniare cu un număr par de atomi de carbon (1-dodecen, 1-tetradecen, 1-hexadecen etc.), utilizate în industria detergenților, se realizează prin polimerizarea controlată a etenei cu catalizatori de către Ziegler- Natta .
Test pentru alchene
Cum să recunoaștem alchenele
Reacție de recunoaștere cu Br 2
Alchenele sunt ușor de transformat de clor sau brom (iodul în general nu reacționează) în dihaluri, compuși saturați care conțin 2 atomi de halogen legați la doi atomi de carbon adiacenți. Reacția de adiție electrofilă are loc prin amestecarea celor doi reactivi în prezența unui solvent inert și se desfășoară rapid la temperatura camerei sau chiar mai scăzută. Dimpotrivă, trebuie evitate temperaturile mai ridicate, excesul de halogen și expunerea la lumina UV, deoarece în aceste condiții substituția ar putea deveni o reacție secundară importantă. Testul este pozitiv (confirmarea prezenței unei legături duble) dacă dispare culoarea roșie a apei de brom (atât dihalura formată, cât și alchena sunt incolore).
Unii agenți oxidanți transformă alchenele în „glicoli”, compuși organici care conțin două grupări „- OH”, caracteristice alcoolilor. Reacția, cunoscută sub numele de hidroxilare, corespunde adăugării a două grupări hidroxil la dubla legătură. Pentru recunoașterea dublei legături, o soluție neutră sau ușor bazică diluată de permanganat de potasiu este utilizată ca agent oxidant. Reacția se efectuează la temperatura camerei. Atât temperaturile ridicate, cât și adăugarea de acizi trebuie evitate, deoarece în aceste condiții se poate produce divizarea legăturii duble. Testul este pozitiv dacă soluția violetă de KMnO 4 dispare și este înlocuită de un precipitat maro de dioxid de mangan.
Pregătiri pentru sinteză
În laborator se pot pregăti alchenele
- deshidratarea alcoolilor
R-CH 2- CH 2 OH → R-CH = CH 2
- reacția este catalizată cu agenți de deshidratare precum alumină , pentoxid de fosfor sau acid sulfuric ; în acest din urmă caz, formarea eterului este competitivă cu cea a alchenei; cu unii alcooli este posibil să se direcționeze rezultatul final acționând asupra condițiilor de reacție
- dehidrohalogenarea halogenurilor de alchil
R-CH 2 -CH 2 X + bază → R-CH = CH 2 (X = Cl, Br, I)
- baza utilizată în general în aceste cazuri este hidratul de potasiu în soluție de etanol ; utilizarea bazelor în soluție apoasă este mai puțin eficientă, deoarece halogenura de alchil este apolară și, prin urmare, nu este foarte solubilă în apă.
- Halogenurile de alchil terțiar sunt cele mai reactive, urmate de secundare și apoi primare. Dintre halogenuri, cu aceeași grupă alchil, iodurile sunt cele mai reactive, urmate de bromuri și apoi de cloruri .
- Atât în acest caz, cât și în deshidratarea alcoolilor, hidrogenul se va pierde preferențial, ceea ce duce la formarea celei mai stabile alchene, adică cea mai substituită - adică cea care poartă cât mai multe grupări alchil pe carbonii angajați în dubla legătură.
- dehalogenarea dihalurilor locale
R-CH-CH2 - | | + Zn → R-CH = CH 2 (X = Cl, Br, I) XX
- Reacția Wittig (de Georg Wittig , care a dezvoltat-o în 1954 ), adică cuplarea dintre o aldehidă sau o cetonă și o ilidă de fosfor , aceasta din urmă preparată in situ prin reacția dintre o fosfină (de obicei trifenilfosfină) și o halogenură de alchil urmată de tratament cu o bază foarte puternică (un alchilitiu în exemplu)
Ph Ph
| |
1. Ph-P + R-CH 2 -X → Ph-P + -CH 2 X -
| | |
Ph Ph R
Ph Ph
| |
2. Ph-P + -CH 2 X - + R-Li → Ph-P + -CH - ilid de fosfor
| | | |
Ph R Ph R
Ph Ph
| |
3. Ph-P + -CH - + R'-C = O → R'-C = CH + Ph-P = O
| | | | | |
Ph RR 'R'R Ph
- Ph reprezintă în mod convențional gruparea fenil , adică un benzen lipsit de un atom de hidrogen, C 6 H 5 -
- Alegerea halogenurii de alchil și a cetonei permite sinteza alchenei dorite.
Este o reacție între o dienă și o alchenă substituită cu grupuri care atrag electronii (numite dienofile ); produce o alchenă ciclică.
ROOC COOR
\ /
CH 2 = CH ROOC COOR CH - CH
\ + \ / → / \
CH = CH 2 CH = CH CH 2 CH 2
\ /
CH = CH
- se încadrează în categoria așa-numitelor reacții electrociclice .
- Reacția de a face față sau eliminarea de a face față
Este o reacție de eliminare în care, prin încălzire, un oxid de amină este transformat într-o alchenă și o N, N-dialchilhidroxilamină.
Reacții tipice
Cea mai mare parte a reactivității alchenelor este exprimată prin reacții de adiție la dubla legătură. Această adăugare poate avea loc cu un mecanism ionic (adiție electrofilă) sau radical .
- adaos de hidrogen (formarea alcanilor )
RR'C = CHR "+ H 2 → RR'CH-CH 2 R"
- apare la temperaturi și presiuni scăzute în prezența catalizatorilor metalici precum platină , paladiu sau nichel , producând alcanul corespunzător.
- Eficiența catalizatorului este direct legată de dispersia și capacitatea sa de a adsorbi alchena; este probabil ca adsorbția să transfere o parte din densitatea electronică a dublei legături către metal, care este astfel slăbit și mai vulnerabil la hidrogen.
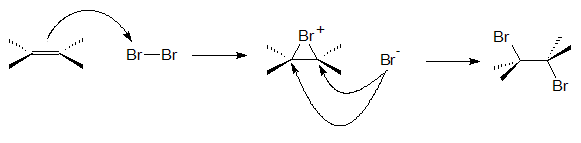
- adaos de halogen
RR'C = CHR "+ X 2 → RR'CX-CXHR" X = Cl, Br
- Este o reacție imediată și completă la temperatura camerei, până la punctul în care o soluție de brom în tetraclorură de carbon este utilizată ca reactiv pentru a caracteriza alchenele, deoarece în prezența lor suferă o schimbare imediată de la portocaliu intens la incolor.
- Adăugarea de halogen la o legătură dublă continuă cu mecanismul indicat aici, în care se formează mai întâi un ion de bromoniu ciclic care este apoi deschis de un anion bromură care se apropie de el din partea opusă prin introducerea pe unul sau pe celălalt dintre cei doi carbon atomii în funcție de obstacol steric.
- mecanismul propus explică de ce adăugarea unui halogen la o cicloalchenă produce numai trans- izomerul -2, dialogenat și nu cis . O adăugare de acest fel se numește anti (spre deosebire de păcat , în care adăugarea are loc pe aceeași parte a legăturii duble).
- formarea halohidrinelor
RR'C = CHR "+ X 2 + H 2 O → RR'C-CHR"
| | X = Cl, fr
X OH
- Este o confirmare suplimentară a formării ionului ciclic intermediar ilustrat în mecanismul anterior.
- Când halogenul este adăugat la alchenă în prezența apei, alcoolul 2-halogenat corespunzător (cunoscut și sub denumirea de clorhidrat sau bromhidrină , în funcție de halogenul utilizat) este obținut împreună cu produsul de halogenare, prin deschiderea ionului ciclic intermediar printr-un OH ion - .
- adăugarea de halogenuri de hidrogen (formarea de halogenuri de alchil )
RR'C = CHR "+ HX → RR'CX-CH 2 R" (X = Cl, Br, I)
- Este o reacție care are loc prin barbotarea acidului halogen uscat în alchenă sau o soluție de alchenă într-un solvent organic polar; apa este evitată deoarece ar putea concura în plus cu acidul și astfel poate transforma alchena în alcoolul corespunzător.
- Când alchena nu este simetrică, adăugarea unei molecule de halogenură de hidrogen poate duce la două produse diferite; conform regulii Markovnikov , enunțată în 1869 în urma studiului sistematic al diferitelor reacții de adiție, se observă că hidrogenul acidului se leagă preferențial de atomul de carbon care are deja mai mulți hidrogeni legați de el însuși , de exemplu
CH3 - CH = CH2 + HCI → CH3 - CH-CH3 și nu CH3 - CH2 - CH2
| |
Cl Cl
- Această orientare se explică prin presupunerea că reacția de adăugare are loc în conformitate cu un mecanism în doi pași. În prima, alchena adaugă la sine ionul H + al acidului formând o carbocație (nu ciclic, ca în cazul adăugării de halogeni, deoarece hidrogenul nu are electroni externi pentru a forma legături suplimentare), care ulterior se leagă la anion. Adăugarea H + conform regulii lui Markovnikov produce preferențial cea mai stabilă carbocație:
CH 3 -CH = CH 2 + H + → CH 3 -CH-CH 3 carbocație secundară: mai stabilă
+
CH 3 -CH 2 -CH 2 + carbocație primară: mai puțin stabilă
- carbocația mai puțin stabilă suferă și transpunere prin schimbarea într-un izomer mai stabil.
- În prezența peroxizilor , mecanismul reacției de adiție nu mai este ionic, ci radical , efectul este inversarea orientării adăugării și, prin urmare, se dă un produs opus celui prezis de regula Markovnikov. Acest lucru se datorează faptului că particula care adaugă all'alchene nu mai este ionul H + , ci radicalul X.
CH 3 -CH = CH 2 + X. → CH 3 -CH-CH 2 radical secundar: mai stabil
. |
X
CH3 - CH-CH2. radical primar: mai puțin stabil
|
X
- radicalul format este apoi combinat cu un radical H. completând adăugarea.
- adaos de apă (hidratare, formare de alcooli )
RR'C = CHR "+ HX → RR'CX-CH 2 R" (X = Cl, Br, I)
- cu un mecanism similar cu cel observat pentru adăugarea acizilor halogenhidri, alchenelor, în prezența unui acid catalizator care este în mod normal acid sulfuric, adăugați o moleculă de apă pentru a da alcoolul corespunzător.
- Orientarea adăugării urmează regula Markovnikov, astfel încât alcoolii secundari și terțiari vor tinde să se formeze preferențial, de exemplu
CH 3 -CH = CH 2 + H 2 O → CH 3 -CH-CH 3 și nu CH 3 -CH 2 -CH 2
| |
OH OH
- sinteza alcoolilor cu orientare anti-Markovnikov din alchene este un proces mai complex, care necesită două etape și se numește hidroborare-oxidare . Acesta constă în adăugarea unui boran la alchenă și ulterior oxidarea acestuia cu peroxid de hidrogen într-un mediu alcalin
1. CH 3 -CH = CH 2 + (BH 3 ) 2 → CH 3 -CH 2 -CH 2
|
BH 2
2. CH 3 -CH 2 -CH 2 + H 2 O 2 → CH 3 -CH 2 -CH 2
| |
BH 2 OH
- adaos de alchili (alchilare, dimerizare, polimerizare)
- Carbocația care se formează prin adăugarea unui ion H + la o alchenă poate, în funcție de condițiile de reacție și structura sa, să se adauge la o altă moleculă de alchenă, formând o carbocație mai mare care poate pierde un ion H + și se poate transforma într-o alchenă sau La rândul său, continuați adăugarea și conduceți la un polimer . Reacția se efectuează prin tratarea alchenei cu acid sulfuric concentrat sau acid fosforic concentrat .
- Un exemplu este dimerizarea 2-metil-2-propenei (mai bine cunoscută sub numele de izobutenă )
+
1. CH 3 -C = CH 2 + H + → CH 3 -C-CH 3
| |
CH 3 CH 3
CH 3
+ | +
2. CH 3 -C-CH 3 + CH 3 -C = CH 2 → CH 3 -C-CH 2 -C-CH 3
| | | |
CH 3 CH 3 CH 3 CH 3
CH 3 CH 3
| + |
3. CH 3 -C-CH 2 -C-CH 3 → CH 3 -C-CH = C-CH 3 + H +
| | | |
CH 3 CH 3 CH 3 CH 3
- În mod similar, dacă carbocația se formează în prezența unui alcan , acestea pot rupe un ion H - all'alcano pentru a-și neutraliza încărcătura și transforma la rândul său într-un alcan, de exemplu
CH 3 CH 3 CH 3 CH 3
| + | | |
3a. CH 3 -C-CH 2 -C-CH 3 + CH 3 -CH → CH 3 -C-CH 2 -CH-CH 3 + CH 3 -C +
| | | | | |
CH 3 CH 3 CH 3 CH 3 CH 3 CH 3
- Adăugarea unui radical la o alchenă începe o reacție de adiție în lanț care duce la polimerul corespunzător. Ca inițiator , adică ca un compus capabil să genereze radicali care inițiază reacția, se folosește în general un peroxid .
1. ROOR → RO .
2. RO . + CH 2 = CH 2 → RO-CH 2 -CH 2 .
3. RO-CH 2 -CH 2 . + CH 2 = CH 2 → RO-CH 2 -CH 2 -CH 2 -CH 2 .
n. ...- CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -...
- formarea diolilor
R-CH = CH-R '+ KMnO 4 → R-CH-CH-R'
| |
OH OH
- legătura dublă tinde, de asemenea, să se deschidă prin oxidare ; tratamentul cu agenți oxidanți foarte ușori, de exemplu permanganat de potasiu într-o soluție puternic alcalină , permite oprirea oxidării într-o etapă inițială, transformând alchena în diolul corespunzător.
- adaos de carben ( ciclizare )
R-CH = CH-R '+ CH 2 N 2 → R-CH --- CH-R'
\ /
CH 2
- carbena este o particulă instabilă care poate exista sub două forme, dintre care una este radicalul bi . CH 2 . care, cu cei doi electroni nepereche, este capabil să se insereze în legătura dublă a unei alchene transformându-l într-un ciclopropan .
- Carbena este de obicei generată in situ prin descompunerea diazometanului , CH 2 N 2 , activat de lumină.
- În mod similar, tratamentul unei alchene cu cloroform și hidrat de sodiu duce la conversia alchenei în 1,1-diclorociclopropan corespunzător după inserarea pe legătura dublă a diclorocarbenei . CCl 2 . generat de acțiunea hidratului de sodiu asupra cloroformului .
- formarea de epoxizi
R-CH = CH-R '+ RCO-O-OH ( peracid ) → R-CH - CH-R'
\ /
SAU
- în mod similar carbenei, un atom de oxigen , cu cei doi electroni nepereche, este capabil să se insereze într-o legătură dublă, transformând alchena în epoxidul corespunzător. Sursa obișnuită de oxigen atomic în acest scop sunt peracizii , adică acizii carboxilici care conțin un atom suplimentar de oxigen, cu o structură similară cu cea a peroxidului de hidrogen .
- substituție radicală
- Alchenele, ca și alcanii, pot suferi reacții de substituție de către radicali ; stabilitatea creată de rezonanță favorizează substituția în poziția alilică , adică pe carbonii adiacenți celor implicați în dubla legătură
. . R-CH 2 -CH = CH 2 → R-CH-CH = CH 2 ↔ R-CH = CH-CH 2
- demolare oxidativă ( ozonoliză )
- Tratamentul cu oxidanți puternici, cum ar fi ozon sau permanganat de potasiu într-o soluție acidă, duce la ruperea dublei legături în vecinătatea căreia alchena se rupe în două fragmente care pot fi cetone , acizi carboxilici și dioxid de carbon , în funcție de puterea a agentului oxidant și a structurii alchenei
RR „RR” \ / \ \ C = C + O 3 -> C = O + C = O / \ / / RHR OH
RHR \ / \ C = C + O 3 -> C = O + CO 2 / \ / RHR
- identificarea fragmentelor este o modalitate de a determina structura alchenei de pornire.
Alchene liniare cu n atomi de carbon
- 2 atomi de C: etenă (sau etilenă)
- 3 atomi de C: propenă (sau propilenă)
- 4 atomi de C: butenă (sau butilenă)
- 5 atomi de C: pentenă
- 6 atomi de C: hexenă
- 7 atomi de C: hepten
- 8 atomi de C: obțineți
Notă
- ^ A b(EN) IUPAC Gold Book, "alkenes"
- ^(RO) IUPAC Gold Book, „olefins”
Bibliografie
- TW Graham Solomons, Organic Chemistry , ediția a II-a, Bologna, Zanichelli, 2001, pp. 47-50, 197-229, ISBN 88-08-09414-6 .
- ( EN ) Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Industrial organic chimie , ediția a IV-a, Wiley-VCH, 2003, pp. 59-90, ISBN 3-527-30578-5 .
Elemente conexe
Alte proiecte
-
 Wikționarul conține dicționarul lemă « alchenes »
Wikționarul conține dicționarul lemă « alchenes » -
 Wikimedia Commons conține imagini sau alte fișiere pe alchene
Wikimedia Commons conține imagini sau alte fișiere pe alchene
linkuri externe
- Exerciții privind Nomenclatura alchenelor , pe mnemochimica.it.
- Experiențe de laborator - Alkenes , pe itchiavari.org .
| Controllo di autorità | Thesaurus BNCF 21153 · LCCN ( EN ) sh85094589 · GND ( DE ) 4001207-4 · BNF ( FR ) cb11948674t (data) · NDL ( EN , JA ) 00562061 |
|---|