Acid maleic
| Acid maleic | |
|---|---|
| Numele IUPAC | |
| Acid Z- butendic | |
| Denumiri alternative | |
| acid cis-butendenic acid toxalic acid cis-1,4-butendenic | |
| Caracteristici generale | |
| Formula moleculară sau brută | C 4 H 4 O 4 |
| Masa moleculară ( u ) | 116.07 |
| Aspect | pudră albă |
| numar CAS | |
| Numărul EINECS | 203-742-5 |
| PubChem | 444266 |
| DrugBank | DB04299 |
| ZÂMBETE | C(=CC(=O)O)C(=O)O |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 1,59 |
| Constanta de disociere a acidului (pKa) la 298 K. | 1,8; 6.1 |
| Solubilitate în apă | 788 g / L |
| Temperatură de topire | 137 ° C (410 K) |
| Temperatura de fierbere | 202 ° C |
| Informații de siguranță | |
| Limite de explozie | mai puțin de 2,7% |
| Simboluri de pericol chimic | |
 | |
| Atenţie | |
| Fraze H | 302 - 315 - 319 - 335 - 317 |
| Sfaturi P | 280 - 302 + 350 - 305 + 351 + 338 [1] |
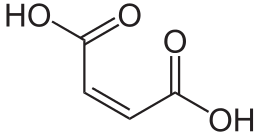
Acidul maleic (sau acidul cis-butendenic ) este un acid dicarboxilic . La temperatura camerei apare ca o pulbere cristalină albă fină, cu un miros acid slab.
Are un pKa de primă ionizare care este în jur de 1,9, prin urmare este foarte acid; în timp ce o a doua ionizare pKa (pKa ') care valorează aproximativ 6.
Izomerul său trans corespunzător este acidul fumaric . Deoarece există o dublă legătură carbon-carbon, rotația și, prin urmare, trecerea de la acidul maleic la acidul fumaric sunt imposibile fără utilizarea unei anumite cantități de energie, dată de hidroliza ATP .
Structura lor diferită influențează profund proprietățile chimice ale celor doi acizi: acidul maleic este toxic pentru organismul nostru, în timp ce acidul fumaric este un intermediar foarte important al multor reacții biochimice.
Acidul maleic este capabil să elibereze mai ușor un proton datorită prezenței grupării carboxilice în cis, ceea ce face posibilă delocalizarea sarcinii negative a anionului prin rezonanță pe patru atomi de oxigen diferiți și nu doar pe doi, ca în acidul fumaric.
Fiind deja încărcat negativ, acidul maleic este mai dificil de suferit a doua disociere din cauza repulsiei electrostatice, în timp ce distanța celor două grupări carboxilice din acidul fumaric reduce interacțiunile intramoleculare, facilitând detașarea celui de-al doilea ion hidrogen.
În rezumat, acidul maleic este mai acid decât fumaric în prima disociere, mai puțin în a doua.
Derivații acidului maleic sunt cunoscuți sub numele de maleates (nu trebuie confundat cu pacienții care derivă din „ acidul malic ).
Se obține industrial din hidroliza anhidridului maleic , obținută la rândul său prin oxidarea n-butanului sau benzenului (acesta din urmă este un proces oarecum depășit).
Notă
- ^ Foaie de acid maleic pe IFA-GESTIS
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre acid maleic
Wikimedia Commons conține imagini sau alte fișiere despre acid maleic
linkuri externe
- ( EN ) Acid maleic , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
| Controlul autorității | GND ( DE ) 4168704-8 |
|---|