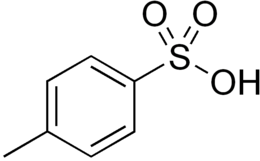
Acid P-toluensulfonic
Această intrare sau secțiune despre subiectele compușilor aromatici și acizilor organici nu menționează sursele necesare sau cei prezenți sunt insuficienți . |
| Acid P-toluensulfonic | |
|---|---|
| Numele IUPAC | |
| Acid 4-metilbenzensulfonic | |
| Denumiri alternative | |
| acid p-toluensulfonic | |
| Caracteristici generale | |
| Formula moleculară sau brută | CH3 C 6 H 4 SO 3 H |
| Masa moleculară ( u ) | 172,20 g / mol |
| Aspect | solid alb cristalin |
| numar CAS | |
| Numărul EINECS | 203-180-0 |
| PubChem | 6101 |
| DrugBank | DB03120 |
| ZÂMBETE | CC1=CC=C(C=C1)S(=O)(=O)O |
| Proprietăți fizico-chimice | |
| Constanta de disociere a acidului la 295 K. | 6,30 × 10 2 |
| Temperatură de topire | 106 ° C (379 K) |
| Temperatura de fierbere | 140 ° C (413 K) |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
 | |
| Atenţie | |
| Fraze H | 315 - 319 - 335 |
| Sfaturi P | 302 + 352 - 304 + 340 - 305 + 351 + 338 [1] |
Acidul p- toluensulfonic [2] ( PTSA sau p TsOH ) sau acidul tosilic ( TsOH ) este un compus organic cu formula CH 3 C 6 H 4 SO 3 H. La temperatura camerei este un solid alb, solubil în apă , alcool și alți solvenți organici polari. Grupul CH 3 C 6 H 4 SO 2 - este cunoscut și sub numele de tosil și este uneori prescurtat cu abrevierea Ts sau Tos. Totuși, mai des, cu inițialele TsOH se referă la forma monohidrat a acidului, CH 3 C 6 H 4 SO 3 H. H 2 O.
Este un acid puternic (de aproximativ un milion de ori mai disociat decât acidul benzoic ) și unul dintre puținii care există în stare solidă la temperatura camerei. Datorită acestei caracteristici este adesea utilizat în reacțiile de chimie organică, de exemplu în esterificarea acizilor carboxilici .
Pregătirea și utilizările
TsOH se prepară la scară industrială prin sulfonarea toluenului . Se hidratează rapid. Impuritățile obișnuite includ acidul benzensulfonic și acidul sulfuric . Acidul P-toluensulfonic monohidrat conține apă cristalină și apă ca impuritate. Pentru a estima umiditatea totală prezentă ca impuritate, se utilizează metoda Karl Fischer. Impuritățile pot fi îndepărtate prin recristalizare din soluția sa apoasă concentrată urmată de uscare azeotropă cu toluen. [3]
TsOH este utilizat în sinteza organică ca catalizator acid "solubil organic". Exemple de utilizări includ:
- Acetalizarea unei aldehide . [4]
- Esterificarea acizilor carboxilici . [5]
- Transesterificarea unui ester . [6]
Tosilates
Tosilații de alchil sunt agenți de alchilare, deoarece tosilatul este retragerea electronilor , ceea ce face ca anionul de tosilat să fie o bună grupare de părăsire. Esterii toluenesulfonatului suferă un atac sau eliminare nucleofilă. Reducerea esterilor tosilat conferă hidrocarbura corespunzătoare. Prin urmare, tosilarea urmată de reducere permite dezoxigenarea alcoolilor.
De asemenea, tosilații protejează grupul pentru alcooli. Acestea sunt preparate prin combinarea alcoolului cu clorură de 4-toluenesulfonil, de obicei într-un solvent aprotic, adesea piridină . [7]
Reacții
TsOH poate fi transformat în anhidridă p-toluensulfonică prin încălzire cu pentoxid de fosfor . [8] Când este încălzit cu acid și apă, TsOH suferă hidroliză în toluen:
Această reacție se aplică tuturor acizilor arilsulfonici. [9] [10]
Notă
- ^ Foaie compusă despre IFA-GESTIS Arhivat 16 octombrie 2019 la Arhiva Internet . accesat la 4.06.2020
- ^ citit: para- toluenesulfonic
- ^ Perrin, DD și Armarego, WLF,Purificarea substanțelor chimice de laborator , Oxford, Pergamon Press, 1988.
- ^ (RO) Sinteze organice , http://www.orgsyn.org/demo.aspx?prep=v77p0236
- ^ (EN) Sinteze organice , http://www.orgsyn.org/demo.aspx?prep=cv9p0722
- ^ (EN) Sinteze organice , http://www.orgsyn.org/demo.aspx?prep=cv8p0201
- ^ Substituție nucleofilă , a chem.ucalgary.ca .
- ^ (RO) Sinteze organice , http://www.orgsyn.org/demo.aspx?prep=cv4p0940
- ^ CM Suter, The Organic Chemistry of Sulfur , New York, John Wiley & Sons, 1944, pp. 387–388.
- ^ JM Crafts, Cataliză în soluții concentrate , în J. Am. Chem. Soc. , Vol. 23, 1901, pp. 236–249.