Acid etilendiaminetetraacetic
| Acid etilendiaminetetraacetic | |
|---|---|
| Numele IUPAC | |
| N, N, N ', N'-tetracarboximetil-1,2-diaminoetan | |
| Abrevieri | |
| EDTA | |
| Caracteristici generale | |
| Formula moleculară sau brută | C 10 H 16 N 2 O 8 și H4EDTA |
| Masa moleculară ( u ) | 292,25 |
| Aspect | solid cristalin incolor până la alb |
| numar CAS | |
| Numărul EINECS | 200-449-4 |
| PubChem | 6049 |
| DrugBank | DB00974 |
| ZÂMBETE | C(CN(CC(=O)O)CC(=O)O)N(CC(=O)O)CC(=O)O |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 0,86 |
| Solubilitate în apă | ~ 0,5 g / l la 20 ° C |
| Temperatură de topire | 220 ° C (493 K ) cu descompunere |
| Presiunea de vapori ( Pa ) la 293 K. | 1.3 |
| Proprietăți termochimice | |
| Δ f H 0 (kJ mol −1 ) | −1759,5 |
| Informații de siguranță | |
| Punct de flacără | > 100 ° C (> 373 K) |
| Temperatură de autoaprindere | > 200 ° C (> 473 K) |
| Simboluri de pericol chimic | |
 | |
| Atenţie | |
| Fraze H | 319 |
| Sfaturi P | 305 + 351 + 338 [1] |
Acid etilendiaminetetraacetic , mai cunoscut prin abrevierea EDTA este un acid carboxilic ; în special, este un acid tetracarboxilic înzestrat și cu două dublete de electroni (donatori Lewis) aparținând azotului. Aceste caracteristici fac din anion etilendiaminetetraacetat EDTA 4− un ligand hexadentat.
La temperatura camerei apare ca o pulbere cristalină moderat solubilă în apă, la care dă o reacție acidă : o suspensie de 10 grame de EDTA într-un litru de apă are un pH de aproximativ 2,5. Pe de altă parte, EDTA este solubilă în soluții alcaline sub formă de anion policarboxilat.
A fost sintetizată pentru prima dată în 1935 de chimistul Ferdinand Münz [2] .
Sinteză
Compusul a fost descris inițial de Ferdinand Münz , care l-a preparat din reacția dintre etilendiamină și acid cloracetic . [3] Astăzi EDTA este sintetizată în principal din etilendiamină (1,2-diaminoetan), formaldehidă (metanal) și cianură de sodiu . [4] Această cale duce la sarea de sodiu care poate fi ușor convertită în acid:
- H 2 NCH 2 CH 2 NH 2 + 4 CH 2 O + 4 NaCN + 4 H 2 O → (NaO 2 CCH 2 ) 2 NCH 2 CH 2 N (CH 2 CO 2 Na) 2 + 4 NH 3
- (NaO 2 CCH 2 ) 2 NCH 2 CH 2 N (CH 2 CO 2 Na) 2 + 4 HCI → (HO 2 CCH 2 ) 2 NCH 2 CH 2 N (CH 2 CO 2 H) 2 + 4 NaCl
Astfel, se produc aproximativ 80.000 de tone de EDTA pe an. Impuritățile cogenerate de această cale sintetică includ glicină și acid nitriloacetic , sunt produse prin reacții secundare ale coprodusilor amino. [5]
Elemente de coordonare chimică a EDTA
În chimia coordonării , EDTA 4− este un membru al familiei ligandilor de acizi poliamino carboxilici . EDTA 4 - se leagă de obicei la un cation metalic prin cele două amine și 4 carboxilați ai săi. Mulți dintre compușii de coordonare adoptă geometria octaedrică. Deși sunt puțin importante pentru aplicațiile sale, aceste complexe octaedrice sunt chirale . Anionul [Co (edta)] - a fost rezolvat în enantiomerii săi. [6] Multe complexe EDTA 4− adoptă structuri mai complexe datorită: (i) formării unei legături suplimentare cu apa, de exemplu complexe cu șapte coordonate sau (ii) deplasării unuia dintre brațele carboxilatului cu o moleculă de apă . Primele cercetări privind dezvoltarea EDTA au fost efectuate de Gerold Schwarzenbach în anii 1940 . [7] EDTA formează complexe deosebit de puternice cu Mn (II), Cu (II), Fe (III), Pb (II) și Co (III). [8]
Unele caracteristici ale complexelor formate de EDTA sunt relevante pentru aplicațiile sale. În primul rând, datorită dentității sale ridicate, acest ligand are o afinitate mare pentru cationii metalici:
- [Fe (H 2 O) 6 ] 3+ + H 4 EDTA ⇄ [Fe (EDTA)] - + 6 H 2 O + 4 H + ( K eq = 10 25,1 )
Scrisă în această formă, constanta de echilibru arată că ionii metalici concurează cu protonii pentru legarea la EDTA. Deoarece ionii metalici sunt înveliți extensiv de EDTA, proprietățile lor catalitice sunt adesea suprimate. De asemenea, deoarece complexele 4- EDTA sunt anionice , ele tind să fie foarte solubile în apă acidă . Din acest motiv, acidul etilen-diamino-tetra-acetic este capabil să dizolve depunerile de oxizi și carbonați metalici.
Angajamente
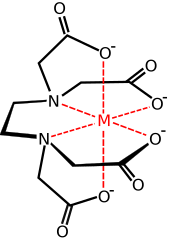
EDTA este utilizat pe scară largă în chimia analitică ca agent chelator , de exemplu în hemoleucogramă . Prezența a patru grupări carboxil și a doi atomi de azot înseamnă că molecula EDTA este capabilă să formeze complexe stabile cu foarte mulți cationi .
Stabilitatea acestor complexe face ca EDTA să fie cel mai popular reactiv pentru măsurarea concentrației de numeroși cationi prin titrare complexometrică . Cel mai frecvent exemplu de aplicare a titrărilor de acest tip este măsurarea durității apei .
EDTA este de fapt capabil să formeze complexe cu ioni de calciu și magneziu , dar și cu ioni de cupru , zinc și numeroase alte elemente.
În practica analitică zilnică, mai mult decât acidul liber, utilizarea sării sale dihidrat de calciu- sodiu C 10 H 14 N 2 O 8 Na 2 Ca 2 H 2 O este frecventă, în special datorită solubilității sale în apă. EDTA calciu-disodic (CaNa-EDTA), care nu trebuie confundat cu EDTA disodic (DSEDTA), este singura formă de EDTA aprobată de FDA ca tratament medical pentru chelarea plumbului . Disodium-EDTA este utilizat în caz de hipercalcemie , datorită afinității sale mai mari și capacității de chelare față de calciu. Magneziul-EDTA posedă aceeași proprietate, folosită ca îngrășământ agricol. Din acest motiv, au o acțiune slabă de chelare în fluxul sanguin, legându-se mai întâi de calciu decât de metale grele.
În cosmetică este utilizat ca aditiv pentru a îmbunătăți acțiunea agenților tensioactivi (scăderea durității apei), pentru a evita râncezirea din cauza contaminării cu ioni de fier și ca adjuvant pentru alți aditivi bactericide.
În stomatologie și mai specific în endodonție în timpul terapiilor canalului radicular, proprietățile chelatoare ale EDTA sunt utile în spălările endocanale, pentru a evita formarea stratului de frotiu, așa-numitul „nămol dentinal” și astfel se obține o curățare optimă.
În farmacologie este utilizat pentru rezolvarea problemelor de intoxicație cu soluții capabile să chelate metalele grele și să formeze un compus care este mai ușor de eliminat. De fapt, EDTA-calciu-disodic este mai asemănător cu mercurul, plumbul, zincul (deci inhibitorul metaloproteazei ), alte metale grele și, în cele din urmă, calciul. EDTA este slab absorbită în tractul gastro-intestinal, mai ales în rect. Doar între 5-15% intră în sistemul cardiovascular, unde poate chela și elimina toxinele din sânge.
În ingineria electrică și, în consecință, în sectorul auto, este un aditiv adecvat pentru reducerea fenomenului de sulfurare (sulfatare necorespunzătoare) de pe electrozi în bateriile inspectabile plumb-acid și liber-acid.
Notă
- ^ Fișă tehnică a acidului etilendiaminetetraacetic pe IFA-GESTIS , pe gestis-en.itrust.de . Adus la 3 iunie 2021 (Arhivat din original la 16 octombrie 2019) .
- ^ Matteo Paolieri, Ferdinand Münz: EDTA și 40 de ani de invenții , în Bull. Hist. Chem. , vol. 42, n. 2, ACS, 2017, pp. 133-140.
- ^ F. Munz, Acizi poliamino carboxilici la IG Farbenindustrie , DE 718 981, 1935; SUA 2 130 505, 1938 .
- ^ (EN) Sinteza EDTA , pe chm.bris.ac.uk.
- ^ (EN) J. Roger Hart, acid etilendiaminetetraacetic și agenți chelatori înrudiți, în Enciclopedia Ullmann de chimie industrială, Weinheim , Wiley-VCH, 2005.
- ^ (EN) S. Kirchner, Barium (Ethylenediaminetetracetato) Cobalt (III) 4-Hydrate , în sinteze anorganice, vol. 5, 1957, pp. 186-188, DOI : 10.1002 / 9780470132364.ch52 .
- ^ Edta - Motm , pe chm.bris.ac.uk.
- ^ AF Holleman și E. Wiberg, Chimie anorganică , San Diego, Academic Press, 2001, ISBN 0-12-352651-5 .
Elemente conexe
Alte proiecte
-
 Wikționarul conține dicționarul lema « EDTA »
Wikționarul conține dicționarul lema « EDTA » -
 Wikimedia Commons conține imagini sau alte fișiere despre acidul etilendiaminetetraacetic
Wikimedia Commons conține imagini sau alte fișiere despre acidul etilendiaminetetraacetic
linkuri externe
- ( EN ) RS Lanigan și TA Yamarik, Raport final privind evaluarea siguranței EDTA, EDTA calciu disodic, EDTA diamoniu, EDTA dipotasic, EDTA disodic, TEA-EDTA, EDTA tetrasodic, EDTA tripotassic, EDTA trisodic, HEDTA și HEDTA trisodic , în Int. J. Toxicol. , 21 Suppl 2, 2002, pp. 95–142, DOI : 10.1080 / 10915810290096522 , PMID 12396676 .
- ( EN ) Spectrul pH-ului complexelor EDTA , pe theoprax-research.com .
- ( EN ) EDTA: Molecula lunii , pe chm.bris.ac.uk.
- ( EN ) Determinarea EDTA a durității totale a apei ( PDF ), pe chem.utk.edu . Adus la 8 iulie 2009 (arhivat din original la 29 octombrie 2006) .
- ( EN ) 507 referințe referitoare la EDTA oral , pe gordonresearch.com . Adus la 8 iulie 2009 (arhivat din original la 23 martie 2009) .
- ( EN ) EDTA: agentul chelator sub control ecologic , su scielo.br , Química Nova, noiembrie-decembrie 2003.
- ( EN ) EDTA: agentul chelator sub control ecologic ( PDF ), su scielo.br , Química Nova, noiembrie-decembrie 2003.

