Colesterol
| Colesterol | ||
|---|---|---|
| Numele IUPAC | ||
| 10 R , 13 R -dimetil-17 R - (6-metileptan-2 R- il) -2,3,4,7,8,9,11,12,14,15,16,17-dodecahidro-1 H -ciclopenta [a] fenantren-3 S -olo | ||
| Denumiri alternative | ||
| (3β) -colest-5-en-3-ol (3β) -hidroxicolest-5-enă (3β) -hidroxi-5-colesten | ||
| Caracteristici generale | ||
| Formula moleculară sau brută | C 27 H 46 O | |
| Masa moleculară ( u ) | 386,65 g / mol | |
| Aspect | alb solid | |
| numar CAS | ||
| Numărul EINECS | 200-353-2 | |
| PubChem | 5997 | |
| DrugBank | DB04540 | |
| ZÂMBETE | CC(C)CCCC(C)C1CCC2C1(CCC3C2CC=C4C3(CCC(C4)O)C)C | |
| Proprietăți fizico-chimice | ||
| Densitate (g / cm 3 , în cs ) | 1,052 | |
| Solubilitate în apă | insolubil [1] | |
| Temperatură de topire | 147 ° C (420 K) | |
| Temperatura de fierbere | ~ 360 ° C (~ 633 K) cu descompunere | |
| Informații de siguranță | ||
| Punct de flacără | 250 ° C (523,15 K) | |
| Fraze S. | 22-24 / 25 | |
Colesterolul este o moleculă organică aparținând clasei de lipide [2] și, mai precis, a sterolilor . Acesta joacă un rol deosebit de important în fiziologia animalelor . Molecula de colesterol are o structură rigidă cu patru inele și este un constituent de neînlocuit al membranelor celulare animale, precum și un precursor al hormonilor steroizi , vitaminei D și acizilor biliari . În patologie contribuie la formarea calculilor biliari și a ateromelor .
Concentrația acestei substanțe în sânge se numește colesterol ; deoarece colesterolul este conținut în lipoproteinele plasmatice din sânge, este utilizat, în termeni mai preciși, pentru a se referi la colesterolul total plasmatic, colesterolulLDL , colesterolul HDL sau colesterolul non-HDL (care include colesterolul transportat de toate lipoproteinele plasmatice cu excepția HDL). Valorile colesterolului pot fi normale, scăzute ( hipocolesterolemie ) sau ridicate ( hipercolesterolemie ), acestea din urmă fiind potențial periculoase pentru sănătatea umană . [3]
Nivelurile ridicate de lipoproteine plasmatice bogate în colesterol (în special LDL) sunt considerate printre cei mai importanți factori de risc cardiovascular și pot provoca boli foarte grave, cum ar fi ateroscleroza , deoarece acestea se acumulează în artere și inițiază o reacție inflamatorie care duce la formarea ateromelor. , al cărui nucleu este bogat în colesterol. Plăcile aterosclerotice pot provoca ocluzia vaselor și, eventual, moartea dacă sunt afectate districtele vitale ( arterele coronare și cerebrale ).
Etimologie și informații istorice
Termenul „colesterol” derivă din greaca veche , χολή („ bilă ”) și στερεός („solid”, deoarece poate fi cristalizat ) combinat cu sufixul olo referitor la alcooli .
Conform rapoartelor lui Antoine-François de Fourcroy (1789), [4] prezența sa, sub formă de solzi, a fost găsită în pietrele vezicii biliare de François Poulletier de La Salle (în jurul anului 1770) [5] și de Benjamin Gottlob Fridericus Conradi ( 1775). [6] [7]
În 1815 Michel Eugène Chevreul a numit această substanță „colesterină”. [7] Termenul „colesterol” a fost folosit în schimb pentru prima dată în 1894, după ce Marcellin Berthelot (1859) și-a descoperit natura alcoolică .
Julius Vogel în 1843 a izolat colesterolul de ateromuri și în 1910 patologul rus Nikolaj Aničkov a descoperit rolul principal al colesterolului în dezvoltarea aterosclerozei experimentale. [8]
Savantul Friedrich Reinitzer (1888) a definit formula empirică (C 27 H 46 O) și Adolf Otto Reinhold Windaus (1919) cea a structurii , corectată ulterior în 1932. [7] În 1975, laureatul Nobel John Cornforth a clarificat stereochimia și configurația stereocentrilor stabilită .
Caracteristici chimice

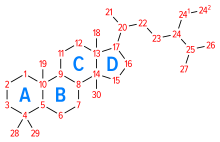
Colesterolul este un alcool policiclic alifatic , format din nucleul peri-hidro-1,2- ciclopentan - fenantrenic (nucleu tetraciclic tipic steroizilor ), cu o dublă legătură în C5 și un lanț lateral izoptil în C17. Finalul -olo derivă din faptul că gruparea hidroxil -OH este prezentă pe C3 a primului inel de atomi de carbon (inelul A). Formula sa de bază este C 27 H 46 O. Dimensiunile sale sunt de 5,2 × 6,2 × 18,9 Å . [1] 1 mmol de colesterol cântărește 386,67 mg . Cele patru inele care alcătuiesc molecula sunt indicate de literele alfabetului (A, B, C, D), toate au o configurație de scaun și o configurație stereochimică trans . Grupul hidroxil din C3, grupările metilice unghiulare în C18 și C19 și lanțul lateral sunt în configurație cis (poziția β).
Colesterolul apare ca o substanță solidă , necombustibilă , aproape inodoră, de culoare albă, cu o consistență similară cu cea a cerii , cu o structură cristalină . În special, se găsește în două forme cristaline: cristale asemănătoare acului și cristale poliedrice (fulgi). Practic insolubil în apă, este modest solubil în alcool și foarte solubil în solvenți organici (de exemplu cloroform și benzen ), în grăsimi și uleiuri . Solubilitatea maximă a colesterolului în soluție apoasă este de numai 1,8 µg / mL sau 4,7 µmol / 100 mL.
Molecula de colesterol este amfiphilică (sau amfipatică), deoarece este prevăzută cu un capăt hidrofil, polar , format din grupul hidroxil și o parte hidrofobă voluminoasă, nepolară, reprezentată de nucleul tetraciclic rigid și lanțul lateral flexibil. Datorită acestei naturi, colesterolul dă naștere, în apă, unei soluții micelare ( concentrație micelară critică , sau CMC, de 2,5 ÷ 4 10-8 M la 25 ° C ) și are o fază lichid-cristalină la 124 ° C de tip smectic . [1] [9] [10]
Gruparea hidroxil poate forma esteri cu acizi grași care se transformă în colesterol esterificat , în timp ce dubla legătură între C5 și C6 permite reacții de adiție .
În corpul uman, colesterolul este prezent atât ca alcool neesterificat (numit și „colesterol liber”), cât și în acest caz este o moleculă amfipatică și ca colesterol esterificat sau ca un ester al colesterolului ( ester al colesterolului ) format din reacția grupării hidroxil cu un acid carboxilic , caz în care esterul rezultat este o moleculă complet apolară. Datorită insolubilității sale în apă, colesterolul circulă în sânge numai în asociere cu lipoproteinele plasmatice .
Funcții biologice
Colesterolul este esențial pentru viața animală , în timp ce este practic absent în plante , unde a fost găsit doar în unele dintre ele și la concentrații relativ scăzute în comparație cu alți steroli. [11] Plantele pot conține substanțe lipidice structurale similare (fitosterine sau fitosteroli ), care diferă de colesterol pentru lanțurile laterale, în special cele din C24: campesterol , β-sitosterol , lanosterol , izofucosterol. [12] Datorită prezenței lanțurilor laterale, funcțiile colesterolului din celulele animale nu pot fi înlocuite cu fitosteroli. [13] [14] Vertebratele sunt capabile atât să sintetizeze colesterolul de novo , cât și să îl utilizeze pe cel prezent în dietă; dimpotrivă, nevertebratele sunt incapabile de sinteză endogenă, dar sunt capabile să transforme fitosterolii în colesterol prin îndepărtarea (de- alchilarea ) lanțului C24. [15] Cele mai importante funcții îndeplinite de colesterol sunt: [16]
Funcții structurale
Colesterolul este o componentă esențială a:
- Membranele tuturor celulelor animale, deoarece este singura specie de lipide din organism care are o structură inelară rigidă, în timp ce toate celelalte lipide de membrană au lanțuri de hidrocarburi remarcabil de flexibile. 85% din colesterolul celular liber se găsește în membrana plasmatică , unde> 90% este introdus în stratul de fosfolipid intern (citoplasmatic) și 3 ÷ 5% în cel extern, [17] orientându-se cu grupul -OH expus la suprafață , corespunzând capetelor polare ale fosfolipidelor . În acest fel scade fluiditatea membranei (vezi modelul mozaicului fluid ), proprietate de care depind funcții importante, de exemplu: permeabilitatea la molecule mici solubile în apă; activitatea receptorilor de membrană și a enzimelor care generează mesageri intracelulari ; stabilitate mecanică; formarea veziculelor pentru transportul conținutului acestora către diferitele organite intracelulare . [18] În special, colesterolul face membranele mai puțin permeabile pentru moleculele mici; este abundentă în membrana plasmatică (aproximativ 50% din lipidele membranei sunt formate din colesterol), în timp ce este redusă (câteva puncte procentuale) în membranele reticulului endoplasmatic și mitocondriile . [19] [20] Deoarece reticulul endoplasmatic este locul în care proteinele sunt asamblate, conținutul scăzut de colesterol facilitează mișcarea proteinelor în interiorul membranei. [21] Așa cum va fi descris în secțiunea despre biosinteză, proteinele care reglează sinteza colesterolului se află în reticulul endoplasmatic și răspund rapid la modificările concentrației sale în membrana reticulară.
- Teacă de nervuri de mielină .
- Creșterea și divizarea celulelor , în special în țesuturile cu rotație mare (de exemplu, epidermă , epitelie ).
- Dezvoltare embrionară : malformațiile nou-născuților după administrarea Contergan la mame au fost cauzate de o perturbare a biosintezei colesterolului; sindroamele de deficit genetic ale enzimelor de biosinteză a colesterolului se caracterizează prin malformații multiple. [22] [23]
Funcțiile metabolice
Colesterolul este compusul de bază în procesele de sinteză ale:
- Hormonii steroizi ai glandelor suprarenale ( aldosteron , cortizol ) și gonade ( testosteron , estradiol etc.).
- Vitamina D , sintetizată în piele sub acțiunea razelor ultraviolete .
- Acizi biliari , pe care ficatul îi secretă cu bilă în duoden pentru a emulsiona lipidele dietetice și a le face absorbabile de intestinul subțire .
Metabolism
Conținutul de colesterol al organismului uman este de aproximativ 150 g; numai creierul conține 30 g [24], iar plasma aproximativ 8 g. Omul produce prin biosinteză autonomă majoritatea colesterolului necesar ( bazin endogen ), doar o mică parte, în medie 0,1 ÷ 0,3 g (maxim 0,5 g), se ia zilnic cu alimente ( bazin exogen ). Ambele bazine sunt supuse mecanismelor de reglare, astfel încât, în condiții de echilibru, cantitatea de colesterol sintetizat plus cea absorbită de alimente corespunde colesterolului eliminat cu bilă ca colesterol liber (la adulți aproximativ 800 ÷ 1400 mg / zi) [25] și sub formă de acizi biliari (aproximativ 500 mg / zi). [26] La adulți, sinteza endogenă zilnică a colesterolului este, prin urmare, între 1 și 2 g. [27] În special, în prezența unei diete care conține 450 mg / zi de colesterol, sinteza endogenă la om este de aproximativ 11 ÷ 13 mg / kg / zi. [28]
Toate celulele organismului sunt capabile să sintetizeze colesterolul pornind de la acetil-coenzima A , dar organul central al metabolismului colesterolului este ficatul .
Ficatul atinge colesterolul exogen provenit din absorbția intestinală , transportat de restul particulelor de chilomicroni ; la acesta se adaugă colesterolul endogen de sinteză hepatică, cel derivat din absorbția de IDL ( lipoproteine cu densitate intermediară ) șiLDL ( lipoproteine cu densitate mică ) și cel al revenirii din țesuturile periferice prin HDL ( lipoproteine cu densitate mare ).
Producția de colesterol endogen este reglementată de componentele dietei , astfel încât sinteza acestuia este inhibată de colesterolul alimentar; trans nesaturați , acizi grași stimulează sinteza endogenă a colesterolului, [29] saturate lauric (C12: 0), miristic (C14: 0) și palmitic (C16: 0) acizi grași , în timp ce creșterea colesterolului, nu au nici un efect asupra sintezei colesterolului [30] [31] [32] (vezi Colesterolemia - Colesterol și nutriție). În hepatocite , colesterolul este apoi asamblat în VLDL ( lipoproteine cu densitate foarte mică ), astfel încât să poată fi transportat pe tot corpul. Colesterolul hepatic este utilizat și pentru secreția sărurilor biliare și a colesterolului liber (neesterificat) din bilă : ficatul este astfel principalul organ capabil să elimine colesterolul din organism.
La nivelul țesuturilor periferice, piscina intracelulară a colesterolului provine parțial din plasma și parțial din sinteza endogenă. Primul constă în colesterolul transportat deLDL care este endocitat datorită intervenției receptorilor specifici LDLR. Când disponibilitatea intracelulară a colesterolului este ridicată, sunt inhibate atât sinteza endogenă a colesterolului, cât și expresia receptorilor LDLR, pentru a evita un exces de colesterol liber în membrane și acumularea acestuia în citoplasmă sub formă de colesterol esterificat. Colesterolul liber poate fi eliminat din membrana plasmatică de HDL-urile care îl transportă înapoi în ficat.
Deoarece LDL-urile nu pot traversa bariera hematoencefalică , creierul trebuie să producă colesterolul de care are nevoie singur. [33] [34] Aproximativ 70% din colesterolul cerebral este produs de oligodendrocite și este conținut în teaca de mielină a axonilor . [35]
Colesterolul este eliminat din organism prin procesul metabolic denumit transport invers al colesterolului (RTC, transport invers al colesterolului). În acest proces, excesul de colesterol este mai întâi transferat din țesuturile periferice în HDL; o parte din colesterolul colectat de HDL este transferat în LDL de către proteina de transfer a esterului colesterolului (CETP). Apoi, colesterolul, prin HDL și LDL, ajunge la singurele două organe capabile să elimine definitiv colesterolul: ficatul și intestinul . Ficatul, așa cum s-a văzut deja, elimină excesul de colesterol primit din HDL și LDL din bilă, în timp ce intestinul este capabil să expulzeze colesterolul primit din LDL direct în lumenul intestinal, datorită prezenței unui sistem de transport prezent în marginea periei de enterocite , un sistem format din proteine ABCG5 și ABCG8 ( transportori de casete de legare ATP G5 / 8). Faza intestinală a transportului invers al colesterolului este cunoscută sub numele de TICE ( excreție de colesterol transintestinal ). [36] [37] Contrar a ceea ce se întâmplă în ficat, în cazul TICE nu există participarea HDL. [38]
Absorbția intestinală
| Mai multe informații - Ouăle cresc colesterolul ? |
|---|
Se crede că ouăle sunt contraindicate în dieta pacienților diabetici și hipercolesterolemici . Numeroase cercetări au arătat inexactitatea acestei afirmații. Un studiu publicat în mai 2018 în American Journal of Clinical Nutrition a arătat că subiecții cu prediabet care au folosit o dietă controlată (cu o atenție deosebită înlocuirii grăsimilor saturate cu grăsimi mononesaturate și polinesaturate ) și care au luat 12 ouă / săptămână timp de 6 luni, nu au prezentat modificări ale nivelului de colesterol comparativ cu cei care au urmat o dietă cu conținut scăzut de ouă, 2 / săptămână. |
Pe lângă 300 ÷ 450 mg / zi de colesterol, [25] dieta occidentală conține în medie aproximativ 70 ÷ 80 g / zi de trigliceride , 5 g / zi de fosfolipide și 400 mg / zi de steroli vegetali ( fitosteroli ), pentru mai mult sitosterol și campesterol (fructe, migdale , nuci , caju , semințe etc.); [39] un ou conține aproximativ 200 mg de colesterol. În dieta SUA, contribuția la colesterol este în medie după cum urmează: 45 ÷ 50% carne și pește, 30 ÷ 35% ouă, 12 ÷ 15% produse lactate și 4 ÷ 6% condimente grase. [40]
În lumenul intestinal, 800-1.400 mg / zi de colesterol endogen din bilă se adaugă la colesterolul dietei, în total 1000-1800 mg / zi: 1/3 aliment (colesterol exogen) și 2/3 biliare (colesterol endogen); la aceste bazine trebuie adăugat faptul că provine din TICE (a se vedea mai sus) și o cantitate nespecificată de colesterol derivată din exfolierea epiteliului intestinal , un procent considerabil din care totuși nu este prezent în mod material în tractul enteric responsabil de absorbție ( duoden și , în mai mică măsură, post ).
Procentul de colesterol luminal absorbit de mucoasa intestinală, cu același conținut alimentar, arată o variabilitate individuală foarte remarcabilă care oscilează între 25% și 75%, în medie în jur de 50%. [41] [42] Absorbția fitosterolilor este în loc de 5% -15%. [43] Procentul absorbit este, de asemenea, invers corelat cu cantitatea de colesterol prezentă în lumenul intestinal, atât în cazul aportului acut (răspuns la o singură administrare), [44], cât și în cel al aportului cronic (răspuns după administrarea prelungită de zile); [45] procentul de absorbție este redus la 25 ÷ 30% atunci când încărcătura de colesterol este mare: un aport alimentar excepțional de 3 g de colesterol duce la o absorbție de aproximativ 1 g. [46] Un caz absolut neobișnuit a fost cel al unei persoane de peste 80 de ani care a consumat în mod obișnuit 25 de ouă pe zi (aproximativ 5 g / zi de colesterol) timp de cel puțin 15 ani: absorbția colesterolului a fost de 18%. [47]
Proporția colesterolului alimentar sub formă esterificată (10 ÷ 15%) este mai întâi hidrolizată în colesterol liber pentru activitatea enzimei colesterol-esterază pancreatică. Datorită efectului acizilor biliari și al moleculelor de lipide amfipatice ( monogliceride , fosfolipide , acizi grași ), colesterolul liber pătrunde în micelele lumenului intestinal, ceea ce îi permite să fie solubilizat. [48] Spre deosebire de colesterolul alimentar, care se găsește mai întâi sub forma unei emulsii și apoi în prezența acizilor biliari în micele, colesterolul endogen ajunge în duoden deja în micelele absorbabile rapid. În forma micelară, colesterolul intră în contact cu marginea periei epiteliului intestinal, din care este absorbit, pentru a fi încorporat în chilomicroni , cu care este eliberat în circulație (70 ÷ 80% sub formă esterificată) prin limfa . [40]
Viteza tranzitului intestinal și cantitatea de steroli vegetali (deoarece aceștia concurează atât pentru încorporarea în micele, cât și pentru transportul în enterocite ) și fibrele alimentare influențează, de asemenea, absorbția colesterolului. Mucina , care acoperă suprafața luminală a enterocitelor, ar putea lega colesterolul și ar facilita absorbția acestuia, deoarece șoarecii MUC1 - / - (cu deficit de mucină) au o reducere de 50% a absorbției colesterolului. [49]
Absorbția în enterocite

Absorbția colesterolului în enterocite are loc prin transportul facilitat (independent de energie), în care sunt implicate o serie de proteine de membrană, a căror importanță relativă nu a fost încă clarificată. În prezent, se pare că „ receptorii scavenger ” SR-B1 și CD36 sunt implicați în transportul colesterolului de la micele la microdomenii membranare bogate în colesterol (numite plute ), dar rolul fundamental este atribuit Niemann-Pick C1-like protein 1 (NPC1L1) [50] [51] (ținta medicamentului ezetimib ).
Conform celei mai acreditate ipoteze, NPC1L1 recrutează colesterolul în membrana apicală, promovează formarea de microdomenii bogate în colesterol și, în cele din urmă, determină endocitoza lor dependentă de clatrin spre reticulul endoplasmatic , unde colesterolul este esterificat de acil-CoA-colesterol- aciltransferaza 2 ( ACAT 2). [52] [53] Proteina NPC1L1 conține secvențe care leagă colesterolul (SSD, domenii de detectare a sterolilor ): activarea acestor secvențe permite interacțiunea NPC1L1 cu complexul AP2 clatrin-proteină, care este responsabil pentru endocitoza plutelor . [54] [55] [56] Odată ce transportul este finalizat, NPC1L1 este transferat înapoi la membrana plasmatică pentru a iniția un nou ciclu. Când concentrația intracelulară a colesterolului este ridicată, NPC1L1 rămâne limitat la reticulul endoplasmatic, ciclul este întrerupt și absorbția colesterolului se oprește. Datorită acestui mecanism de control ( feedback negativ), organismul este capabil să moduleze procentul de colesterol alimentar care este absorbit.
Selectivitatea sistemelor de transport asigură o absorbție mai mare a colesterolului comparativ cu fitosterolii, care sunt foarte slab absorbiți. Mai mult, două proteine ale membranei luminale a enterocitelor sunt responsabile pentru eliminarea surplusului de steroli absorbiți (atât colesterol, cât și în special sitosteroli): ABCG5 și ABCG8; mutația lor este cauza β- sitosterolemiei . [48] Rezultă că concentrația plasmatică a fitosterolilor este foarte scăzută (<1 mg / dL). [39] Deoarece fitosterolii nu sunt sintetizați în corpul uman, nivelurile de colesterol sunt utilizate în cercetarea clinică ca marker al absorbției sterolului intestinal (deși cu unele rezerve). [57] [58]
Biosinteza
Colesterolul se formează din acetil-CoA . În etapa inițială, trei molecule de acetil-CoA sunt condensate pentru a forma acid mevalonic care este transformat într-o unitate izoprenoidă, izopentenil pirofosfat . Izoprenoizii sunt o familie de compuși ale căror structuri sunt formate din unități de izopren . În procesul de biosinteză au loc ulterior o serie de condensări care dau naștere lanțurilor izoprenoide progresiv mai lungi: geranil pirofosfat , farnesil pirofosfat , geranilgeranil pirofosfat și în cele din urmă squalen . În ultimele etape, squalenul ciclizează pentru a forma lanosterol , care este apoi transformat în colesterol. Biosinteza unei molecule de colesterol necesită energie (18 ATP ), 27 NADPH și 11 O 2 ; din acest motiv organismul profită de absorbția colesterolului din dietă. [15]
Studiul biosintezei colesterolului se poate face cu ușurință prin examinarea monocitelor . [59] Etapele biosintetice complexe urmează calea metabolică a acidului mevalonic și sunt după cum urmează: [60] [61]
- În prima etapă există conversia acetil-CoA în acid mevalonic . În primul rând, două molecule de acetil-CoA se condensează pentru a forma acetoacetil-CoA ; apoi acetoacetil-CoA reacționează cu o altă moleculă de acetil-CoA pentru a forma 3-hidroxi-3-metilglutaril-CoA sau HMG-CoA; acesta din urmă este redus la acid mevalonic de enzima HMG-CoA reductază , enzima care reglează întreaga biosinteză a colesterolului. Primele două reacții sunt reversibile, în timp ce a treia este ireversibilă și determină viteza biosintezei;
- În a doua etapă există formarea unităților de izopren activ (bogate în fosfat). Primele două grupări fosfat (un pirofosfat) sunt adăugate la mevalonat prin transfer de la ATP (3 molecule care sunt hidrolizate producând 3 ADP , un fosfat și un pirofosfat) și se formează prima unitate izoprenică, Δ 3 - pirofosfatul izopentenil ;. Ulterior, prin condensarea a două molecule de Δ 3 - izopentenil pirofosfat , se produce geranil pirofosfat care adaugă o altă moleculă de Δ 3 - izopentenil pirofosfat pentru a forma farnesil pirofosfat.
- În a treia etapă, prin condensare între două molecule de farnesil pirofosfat, în care se eliberează grupările pirofosfat, se formează squalenul , o hidrocarbură polinesaturată.
- În etapa a patra, squalenul este transformat în colesterol. Molecula liniară de squalen este ciclizată pentru a forma lanosterol . În cele din urmă, lanosterolul este transformat în colesterol prin deplasarea sau îndepărtarea grupărilor metil .
Reglarea biosintezei colesterolului
L'enzima chiave (enzima regolatore) della sintesi del colesterolo è la 3-idrossi-3-metilglutaril-CoA-reduttasi ( HMG-CoA reduttasi ), presente nella membrana del reticolo endoplasmatico .
La biosintesi del colesterolo è regolata dalla concentrazione intracellulare di isoprenoidi, lanosterolo, colesterolo, ossisteroli e da alcuni ormoni , in primo luogo insulina e glucagone . Un'elevata concentrazione intracellulare di isoprenoidi (farnesil-pirofosfato) e di steroli (colesterolo e, soprattutto, lanosterolo) inibisce l'enzima HMG-CoA riduttasi, bloccando la biosintesi di nuovo colesterolo. In caso di carenza di colesterolo l'emivita dell'HMGCoA riduttasi è di oltre 12 ore, mentre nel caso opposto l'emivita è inferiore a 1 ora circa. [62] Anche il carciofo e l' aglio bloccano la sintesi del colesterolo per inibizione della HMG-CoA reduttasi; l'aglio inibisce anche la lanosterolo-14alfa-demetilasi. [63] L'insulina stimola la sintesi endogena di colesterolo, mentre il glucagone la inibisce. [64] [65] [66]
Questi fattori di controllo creano un meccanismo di feedback negativo tra assorbimento intestinale e sintesi endogena di colesterolo: in questo modo la quantità di colesterolo sintetizzato è inversamente proporzionale alla quantità di colesterolo assunto con la dieta. Tuttavia l'efficienza del meccanismo di feedback varia ampiamente tra gli individui. Ad esempio, nel lavoro di McNamara, a cui si riferisce il grafico riportato a fianco, a fronte di un aumento del contenuto in colesterolo della dieta, gli individui cosiddetti compensatori mostravano una riduzione della sintesi del 26%, mentre per i soggetti non-compensatori la riduzione era del 12%; in questo studio i non-compensatori erano circa il 30% della popolazione esaminata. [45]
Basandosi sui markers di assorbimento degli steroli (sitosterolo, campesterolo e colestanolo) e di markers di sintesi del colesterolo (derivati del lanosterolo, come latosterolo e desmosterolo), è stata proposta una classificazione degli individui in «alti assorbitori/bassi sintetizzatori» e «bassi assorbitori/alti sintetizzatori». [67] [68] Hoenig (2006) ha proposto che il rapporto colestanolo/colesterolo venga utilizzato per classificare gli individui in 3 fenotipi: assorbitori (alto rapporto), sintetizzatori (basso rapporto) e fenotipo misto. [69] L'utilità pratica di questa classificazione, soprattutto alla luce di una possibile guida alla terapia ipocolesterolemizzante (ezetimibe vs statine), non è stata dimostrata.
La più comune sindrome genetica da difetto dei processi di biosintesi del colesterolo è la sindrome di Smith-Lemli-Opitz (SLOS), una sindrome rara (1 su 20.000÷50.000 nati) dovuta a deficit dell'enzima 7-deidrocolesterolo reduttasi . [70] [23]
Trasporto nell'organismo
Visto che il colesterolo, come tutti i grassi , non è solubile nel sangue , per il trasporto ematico deve essere "imballato" in complessi aggregati, sferici o discali, di trasporto ( lipoproteine plasmatiche ). Questi aggregati consistono essenzialmente di:
- un involucro a singolo strato di fosfolipidi ;
- apolipoproteine e colesterolo non esterificato intercalati nell'involucro di fosfolipidi;
- un nucleo idrofobico di acidi grassi , trigliceridi e colesterolo esterificato .
Le lipoproteine plasmatiche vengono classificate in base al loro peso specifico , che varia da <0,98 a 1,17 g/cm 3 e che dipende dalla loro composizione lipidica (maggiore è il contenuto lipidico, minore è il peso specifico). Secondo il peso specifico si distinguono le seguenti classi di lipoproteine plasmatiche: chilomicroni , VLDL ( very low density lipoproteins ), IDL ( intermediary density lipoproteins ), LDL ( low density lipoproteins ), HDL2 e HDL3 ( high density lipoproteins ).
I chilomicroni sono prodotti dall'epitelio intestinale, durante la fase prandiale: il colesterolo e gli altri lipidi assorbiti vengono "assemblati", insieme ai lipidi neosintetizzati, con le apolipoproteine e secreti sotto forma di chilomicroni. Questi, in seguito all'idrolisi da parte della lipoprotein-lipasi presente sulla superficie delle cellule endoteliali , cedono trigliceridi (in forma di acidi grassi e glicerolo ) ai tessuti periferici e, come "chilomicroni rimanenti" ricchi di colesterolo, portano il loro contenuto al fegato.
Nel fegato , soprattutto durante il digiuno , i lipidi vengono incorporati nelle VLDL, le quali vengono rilasciate nella circolazione sanguigna. Nel microcircolo, le VLDL sono idrolizzate dalla lipoprotein-lipasi endoteliale, rilasciando gran parte del proprio contenuto di trigliceridi (che diffondono nei tessuti) e trasformandosi in IDL o particelle rimanenti. Le IDL sono quindi idrolizzate a livello epatico (lipasi epatica) e convertite in LDL, ricche di colesterolo.
In circolo, tra le diverse classi di lipoproteine avviene uno scambio di componenti sia lipidici sia proteici. In particolare, si verifica un trasferimento di trigliceridi dalle apoB-lipoproteine (VLDL, IDL, LDL) alle HDL e di colesterolo esterificato in direzione inversa per opera della proteina per il trasferimento degli esteri del colesterolo o CETP ( cholesteryl ester transfer protein ).
In corrispondenza dei capillari , le LDL fuoriescono dalla circolazione e, dopo aver attraversato la matrice fondamentale del tessuto connettivo , raggiungono le cellule parenchimali , alla cui superficie si legano tramite l'interazione con il recettore per le LDL, e vengono trasportate nell'interno delle cellule , cedendo così il loro carico di colesterolo. Per evitare che le cellule siano sovraccaricate di colesterolo, i recettori LDLR sono soggetti a un meccanismo di controllo a feedback negativo , ovvero quando il contenuto di colesterolo libero nelle membrane cellulari diviene sovrabbondante, la sintesi dei recettori è soppressa.
Poiché il colesterolo in eccesso non può essere degradato nelle cellule, esso può essere immagazzinato nel citoplasma come gocce di colesterolo esterificato oppure può essere trasportato come colesterolo libero nella membrana plasmatica, da dove viene trasferito alle HDL grazie all'intervento di alcune proteine di trasporto di membrana (ABCA1, ABCG1/G4) e del recettore SR-B1 ( scavenger receptor B1 ). In questo modo, le HDL raccolgono il colesterolo libero in eccesso dai tessuti periferici, lo immagazzinano in forma di colesterolo esterificato (per effetto dell'enzima LCAT, Fosfatidilcolina-sterolo O-aciltransferasi ) e lo trasportano al fegato (cosiddetto "trasporto inverso del colesterolo"), affinché possa essere eliminato con la bile . [71] .
Colesterolemia
Quando in medicina si parla di "colesterolo", non si intende il colesterolo inteso come sostanza chimica (si tratta di un'ambiguità semplificatoria), ma si parla delle lipoproteine plasmatiche che circolano nel sangue durante il digiuno: la relativa concentrazione si chiama colesterolemia . La colesterolemia viene distinta in colesterolemia totale, LDL, non-HDL (colesterolo totale - HDL) e HDL: livelli elevati dei primi tre parametri sono considerati dannosi per la salute, mentre alla colesterolemia HDL è attribuito un ruolo protettivo. Il colesterolo non-HDL include VLDL, lDL e LDL; in generale i livelli plasmatici del colesterolo non-HDL corrispondono al valore delle LDL + 30 mg / dL . [72]
I valori della colesterolemia dipendono da:
- equilibrio tra assorbimento intestinale, sintesi endogena, eliminazione biliare del colesterolo e trasformazione del colesterolo in acidi biliari ;
- tempo di persistenza in circolo delle lipoproteine plasmatiche, che è funzione del loro metabolismo plasmatico, influenzato dall'azione di alcuni enzimi (LCAT, CETP) , dalla degradazione per opera delle varie lipasi (lipoproteinlipasi, lipasi epatica, lipasi endoteliale), dall'esistenza di una moltitudine di varianti genetiche delle apolipoproteine e dalla rimozione dal plasma tramite i recettori specifici.
Grazie agli studi epidemiologici è stato possibile attestare l'esistenza di una relazione positiva tra valori inappropriati (valori eccessivamente alti rispetto al rischio cardiovascolare globale ) di colesterolemia totale e di colesterolemia LDL e malattie cardiovascolari (CV) su base ischemica. Le indagini sperimentali hanno chiarito che il trait d'union tra colesterolemia e malattie CV ischemiche è costituito dall'accumulo delle lipoproteine plasmatiche nella parete arteriosa : tale fenomeno dà l'avvio alla serie di reazioni che portano all' aterosclerosi e alla formazione delle placche aterosclerotiche ( ateromi ) nelle arterie . Le placche, per effetto dei fenomeni infiammatori possono ulcerarsi e così favorire la formazione di un trombo che può ostruire, più o meno completamente, l'arteria.
Su raccomandazioni dell' organizzazione mondiale della sanità (OMS), i valori consigliati di colesterolemia nella popolazione generale sono: [73] [74]
- colesterolemia totale inferiore a 200 mg/dl (limiti più restrittivi sono suggeriti dalle varie linee guida, come quelle della Società Europea di Cardiologia, per i soggetti con più fattori di rischio cardiovascolare ) [75]
Numerosi studi epidemiologici (MRFIT, CARDIA, CHH, Progetto CUORE) hanno infatti dimostrato che, nella popolazione generale, la più bassa mortalità totale e cardiovascolare si registra negli individui con colesterolo totale <200 mg/dl, pressione arteriosa <120/80, indice di massa corporea (BMI) <25 kg /m 2 , non fumatori e non diabetici . [76]
Fondamentale è anche la suddivisione tra frazione di colesterolo LDL e HDL: tanto più il rapporto è favorevole alla prima, tanto più alto è il rischio di malattie CV. Il rapporto ottimale colesterolo totale/HDL è non superiore a 5 per gli uomini ea 4,5 per le donne. L'unione dei due parametri (colesterolo LDL e rapporto colesterolo totale/HDL) consente una migliore predittività dei rischi di mortalità CV. [73]

Ipercolesterolemia

L' ipercolesterolemia è una dislipidemia caratterizzata da un'elevata concentrazione plasmatica di colesterolo totale e LDL. Anche se è convenzione considerare elevati i valori che eccedono il 95º percentile di quelli della popolazione in esame, in questo caso la soglia per diagnosticare l'ipercolesterolemia è posta a 240 mg/dL a digiuno da 12 ore. [76] Tuttavia, come esposto sopra, i valori desiderabili di colesterolemia mutano a seconda del rischio CV globale.
L'ipercolesterolemia può presentarsi in forma primaria, come ipercolesterolemia familiare (causata da mutazioni del recettore LDL), come altre forme familiari monogeniche (es. mutazioni dell'apolipoproteina apoB-100) o nella più comune forma poligenica (dovuta alla combinazione di fattori dietetici e fattori genetici); [77] l'ipercolesterolemia è spesso secondaria, associata ad altre malattie endocrine e metaboliche, come il diabete mellito di tipo 2, la sindrome metabolica o le malattie della tiroide . Come altre malattie del metabolismo dei lipidi , l'ipercolesterolemia implica un rischio elevato di aterosclerosi .
I parametri metabolici caratteristici dell'ipercolesterolemia sono:
- colesterolo totale elevato
- lipoproteine a bassa densità (LDL) alte
- lipoproteine a bassissima densità (VLDL) normali o elevate
- beta-lipoproteine alte
- trigliceridi normali o elevati.
Clinicamente l'ipercolesterolemia familiare (FH) si manifesta con ipercolesterolemia totale molto elevata (300÷1 000 mg/dL) e alti livelli di LDL, xantomi , tendinosi , xantelasmi e arcus lipoides corneae (alone intorno alla pupilla ).
Ipocolesterolemia
L'ipocolesterolemia è identificata da una concentrazione di colesterolo plasmatico totale inferiore al 5º percentile della popolazione di riferimento. I livelli di colesterolo che definiscono l'ipocolesterolemia variano, a seconda della popolazione presa in esame, tra <120 mg/dL e <160 mg/dL. [78]
Sulla base di un criterio eziologico si distinguono forme primitive (familiari e no), su base genetica, e forme secondarie, causate da: malattie concomitanti, quali malassorbimento intestinale, ipertiroidismo , insufficienza epatica grave, neoplasie maligne, malattie infettive acute o croniche ( sepsi , tubercolosi ), alcune anemie croniche; malnutrizione ; condizioni critiche mediche e chirurgiche (politraumatizzati, grandi interventi chirurgici). La comparsa e il progressivo aggravamento dell'ipocolesterolemia nei pazienti critici hanno un significato prognostico sfavorevole. [78]
Basi razionali della terapia ipocolesterolemizzante
Tenendo presente quanto illustrato nel paragrafo del metabolismo del colesterolo, i farmaci ipocolesterolemizzanti possono essere raggruppati in classi sulla base del principale step metabolico bersaglio della loro azione. Una possibile classificazione, ispirata con qualche modifica a quella proposta da Rzman e Monostory nel 2010 [79] , potrebbe essere la seguente.

Inibitori dell'assorbimento intestinale del colesterolo
Vi appartiene l' ezetimibe . L'ezetimibe inibisce di oltre il 50% l'assorbimento del colesterolo presente nel lume dell' intestino tenue , legandosi alla proteina NPC1L1 e inibendo il trasporto degli steroli (colesterolo e fitosteroli) negli enterociti . Ne consegue una ridotta incorporazione di colesterolo nei chilomicroni e, quindi, un minore apporto di colesterolo al fegato in forma di chilomicroni remnants . Questo minor apporto di colesterolo induce l'espressione dei geni epatici che regolano sia la sintesi endogena del colesterolo, sia soprattutto quella dei recettori per le LDL. Quest'ultimo effetto promuove la captazione epatica delle LDL plasmatiche. Come risultato, in monoterapia (10 mg/die), l'ezetimibe riduce del 15÷20% la concentrazione plasmatica del colesterolo LDL (LDL-C) e di oltre il 40% le concentrazioni di campesterolo e sitosterolo . [80] [81]
Inibitori della sintesi endogena del colesterolo

Vi fanno parte le statine che si sono rivelate i farmaci più efficaci nel trattamento dell'ipercolesterolemia, sia in termini di riduzione della colesterolemia sia di diminuzione degli eventi cardiovascolari, fatali e non: sono i farmaci di prima scelta per la terapia dell'ipercolesterolemia. [82] Nel gruppo sono compresi anche altri farmaci che inibiscono la sintesi del colesterolo agendo, rispetto alle statine, più a monte (inibitori dell'ACL, ATP citrate lyase quali l' acido bempedoico ) [83] o più a valle (ad esempio inibitori della squalene-sintetasi, ancora in fase di studio) [79] [84] [85] nella via biosintetica del colesterolo.
Le statine sono inibitori competitivi dell'enzima HMG-CoA reduttasi , da cui dipende non solo la sintesi del colesterolo, ma anche quella di isoprenoidi , dolicolo (un poli-isoprenoide) e ubiquinone (o coenzima Q10). Il principale sito di azione delle statine è il fegato. Le statine permettono una riduzione di LDL-C fino al 50% circa. [86] Le azioni terapeutiche delle statine possono essere attribuite principalmente alla riduzione del colesterolo intra- ed extra-cellulare e degli isoprenoidi farnesil pirofosfato e geranilgeranil pirofosfato . Alla ridotta sintesi di ubiquinone e dolicolo, isopentenil pirofosfato e isoprenoidi sono probabilmente dovuti gli effetti tossici delle statine. [87] [88] L'effetto ipocolesterolemizzante delle statine è dovuto all'inibizione della sintesi endogena del colesterolo. La riduzione del colesterolo intracellulare che ne consegue attiva i geni dei recettori LDL e ciò comporta una maggiore captazione cellulare delle LDL plasmatiche: il risultato è la riduzione della colesterolemia. Gli effetti della riduzione del colesterolo intracellulare sono dipendenti dall'attivazione del fattore di trascrizione genica, SREBP-2, che viene controllato dalla concentrazione cellulare di colesterolo. SREBP-2 attiva i geni dei recettori LDL e di alcuni enzimi liposintetici ( in primis HMG-CoA-reduttasi ); [86] nell'uomo prevale nettamente il primo effetto, mentre nel topo è maggiore il secondo: l'induzione compensatoria dell'HMG-CoA-reduttasi nei ratti risulta in un aumento della sintesi di colesterolo, che depotenzia l'effetto ipocolesterolemizzante delle statine.
Inibitori della produzione epatica delle lipoproteine plasmatiche

Includono nuovi farmaci che agiscono sulla fase di assemblaggio delle lipoproteine. [89] Il mipomersen (Kynamro) è un oligonucleotide antisenso (AON, antisense oligonucleotide ) per l'ApoB100: un frammento di RNA messaggero che interferisce con la normale sintesi delle apoproteine B100. Mipomersen riduce la produzione di lipoproteine ApoB100, senza bloccare completamente l'assemblaggio delle VLDL nel fegato; LDL-C si riduce del 25÷28%. [90] La lomitapide (Juxtapid e Lojuxta) inibisce la proteina MTP ( microsomal triglyceride transfer protein ), che permette l'assemblaggio delle lipoproteine nel reticolo endoplasmatico degli epatociti e degli enterociti. L'inibizione della produzione delle VLDL consente di abbassare i livelli delle LDL che da queste hanno origine. [91] [92] Lojuxta riduce del 40% circa sia il colesterolo LDL sia i trigliceridi. [93] Entrambi i farmaci sono associati a un possibile rischio di steatosi epatica per accumulo di trigliceridi negli epatociti, quale effetto della loro mancata incorporazione e secrezione con le VLDL, ma questo pericolo è minore nel caso di mipomersen. [94]
Farmaci interferenti con il metabolismo delle lipoproteine plasmatiche
Comprendono i farmaci ipocolesterolemizzanti che intervengono sul metabolismo plasmatico delle lipoproteine. I rappresentanti più importanti di questo raggruppamento sono gli inibitori della CETP ( cholesteryl ester transfer protein ) e gli inibitori della PCSK9 ( Proprotein Convertase Subtilisin/Kexin Type 9 ). I primi bloccano il trasferimento degli esteri del colesterolo dalle HDL alle altre lipoproteine plasmatiche e hanno come effetto la riduzione di LDL-C e l'aumento di HDL-C. Tre di questi farmaci ( torcetrapib , evacetrapib e dalcetrapib) hanno dato risultati deludenti, un quarto (anacetrapib) si è rivelato promettente in un grande trial, riducendo LDL-C del 40%, aumentando HDL-C del 100% circa e diminuendo l'incidenza di eventi coronarici (-9%). [95] [96] I secondi sono costituiti da anticorpi monoclonali che bloccano l'attività della PCSK9, proteina che agisce come chaperone , presente principalmente nel fegato (ma anche nell' intestino e nel rene ). In condizioni fisiologiche la PCSK9, una volta liberata in forma attiva nell'ambiente extracellulare, si lega al recettore delle LDL e ne promuove la degradazione nei lisosomi : di conseguenza viene impedita la rimozione epatica delle LDL dal plasma. L'inibizione della PCSK9 da parte di evolocumab , alirocumab e bococizumab riduce LDL-C di circa il 60%. [97] [98]
Dal 2020 è stato approvato anche inclisiran , un siRNA che impedisce la traduzione eucariotica della PCSK9 [99] .
Farmaci stimolatori dell'eliminazione del colesterolo dall'organismo

Sono rappresentati dai farmaci sequestranti gli acidi biliari : colestiramina , colestipolo e colesevelam . [100] [101] Si tratta di resine a scambio anionico che non vengono assorbite dall'intestino, ma che nel lume enterico legano i sali biliari impedendone il riassorbimento nel tratto terminale dell' ileo . Questi composti si presentano come voluminosi polimeri che scambiano i loro anioni , soprattutto il cloruro (Cl - ), con gli acidi biliari. La perdita di questi ultimi nelle feci, stimola a livello epatico la conversione del colesterolo in acidi biliari; la conseguente deplezione intracellulare di colesterolo induce una maggiore espressione dei recettori per le LDL, con il risultato di abbassare i livelli plasmatici di LDL-C del 10÷20% circa. Le resine a scambio ionico legano anche le vitamine liposolubili ( vitamine A , D , E e K ), per cui possono causare deficit vitaminico.
Ipocolesterolemizzanti con target principale nelle HDL
Tra i farmaci ipocolesterolemizzanti la niacina (o acido nicotinico) si impone come il farmaco più efficace per aumentare i livelli delle HDL. [102] La niacina ei farmaci derivati ( acipimox ) inibiscono la produzione epatica di VLDL e innalzano i livelli delle HDL. [103] L'effetto sulle VLDL è legato all'inibizione della sintesi di trigliceridi nel fegato attraverso due meccanismi principali: inibizione della lipolisi nel tessuto adiposo , che causa un minor apporto di acidi grassi al fegato, e blocco diretto nel fegato dell'enzima DGAT-2 ( diacylglycerol acyltransferase 2), enzima regolatore della sintesi dei trigliceridi. La carenza di trigliceridi nel reticolo endoplasmatico degli epatociti provoca la degradazione delle apoproteine B100, cosicché risulta ostacolata la formazione delle VLDL. L'aumento della concentrazione del colesterolo HDL è determinata soprattutto dal minore trasferimento di esteri del colesterolo dalle HDL alle VLDL e alle LDL. Alte dosi di niacina (2 g) abbassano LDL-C del 10÷25% e trigliceridi del 20÷50%, aumentano le HDL del 15÷35% e diminuiscono il rischio di eventi coronarici. [104] [105]
Note
- ^ a b c ( EN ) ME Haberland, Self-association of Cholesterol in Aqueous Solution ( PDF ), in Proc. Nat. Acad. Sci. USA , vol. 70, 1973, p. 2315, PMID 4525165 .
- ^ McMurry , p.63 .
- ^ Colesterolemia , in Treccani, dizionario della salute , 2010.
- ^ ( FR ) AF De Fourcroy, De la substance feuilletée et cristalline contenue dans les calculs biliaires, et de la nature des concrétions cystiques cristalisées. , in Ann. Chim. , vol. 3, 1789, pp. 242-252.
- ^ E. Ferroni (a cura di), Enciclopedia della chimica , vol. 3, Firenze, USES, 1974, p. 608.
- ^ Kuntz , p.10 .
- ^ a b c RP Cook , pp. 1-2 .
- ^ Friedman , p. 252 .
- ^ ( EN ) CR Loomis, The phase behavior of hydrated cholesterol ( PDF ), in J. Lipid Res. , vol. 20, 1979, pp. 525-535, PMID 458269 .
- ^ ( EN ) PF Renshaw, On the nature of dilute aqueous cholesterol suspensions ( PDF ), in J. Lipid Res. , vol. 24, 1983, pp. 47-51, PMID 6833881 .
- ^ Cholesterol , su Dr. Duke's Phytochemical and Ethnobotanical Database . URL consultato il 26 febbraio 2018 .
- ^ Phytosterols, phytostanols and their esters - Chemical and Technical Assessment ( PDF ), su fao.org . URL consultato il 26 febbraio 2018 .
- ^ ( EN ) F. Xu, Dual roles for cholesterol in mammalian cells , in Proc. Natl. Acad. Sci. USA , vol. 102, 2005, pp. 14551-14556, PMC 1239893 .
- ^ ( EN ) HA Scheidt, Cholesterol's aliphatic side chain modulates membrane properties , in Angew Chem. Int. Ed. Engl , vol. 52, 2013, pp. 12848-12851, PMC 4011182 .
- ^ a b ( EN ) L. Ge, The Cholesterol Absorption Inhibitor Ezetimibe Acts by Blocking the Sterol-Induced Internalization of NPC1L1 , in Cell Metabolism , vol. 7, 2008, pp. 508-519, DOI : 10.1016/j.cmet.2008.04.001 , PMID 18522832 .
- ^ ( EN ) FR Maxfield, Cholesterol, the central lipid of mammalian cells , in Curr. Opin. Cell Biol. , vol. 22, 2010, pp. 422–429, PMC 2910236 .
- ^ ( EN ) CJ Fielding, Intracellular cholesterol transport , in J. Lipid Res. , vol. 38, 1997, pp. 1503-1521, PMID 9300773 .
- ^ Widmaier , p. 49 .
- ^ ( EN ) MS Bretscher, Cholesterol and the Golgi Apparatus , in Science , vol. 261, 1993, pp. 1280-1281, PMID 8362242 .
- ^ ( EN ) M. Ohashi, Localization of Mammalian NAD(P)H Steroid Dehydrogenase-like Protein on Lipid Droplets , in J. Biol. Chem. , vol. 278, 2003, pp. 36819-36829, PMID 12837764 .
- ^ ( EN ) I. Nilsson, Inhibition of Protein Translocation across the Endoplasmic Reticulum Membrane by Sterols , in J. Biol. Chem. , vol. 276, 2001, pp. 41748-41754, PMID 11535595 .
- ^ ( EN ) FD Porter, Malformation syndromes due to inborn errors of cholesterol synthesis , in J. Clin. Invest. , vol. 110, 2002, pp. 715–724, PMID 12235098 .
- ^ a b ( EN ) FD Porter, Malformation syndromes caused by disorders of cholesterol synthesis , in J. Lipid Res. , vol. 52, 2011, pp. 6–34, PMID 20929975 .
- ^ Puri , p.250 .
- ^ a b ( EN ) JM. Lecerf, Dietary cholesterol: from physiology to cardiovascular risk ( PDF ), in Br. J. Nutr. , vol. 106, 2011, pp. 6-14, PMID 21385506 .
- ^ Rodès , p.174 .
- ^ ( EN ) DE Cohen, Balancing Cholesterol Synthesis and Absorption in the Gastrointestinal Tract , in J. Clin. Lipidol. , vol. 2, 2008, pp. S1–S3, PMC 2390860 .
- ^ ( EN ) KM Kostner, Understanding Cholesterol Synthesis and Absorption Is the Key to Achieving Cholesterol Targets ( PDF ), in Asia Pacific Cardiology , vol. 1, 2007, pp. 7-10.
- ^ ( EN ) K. Sundram, Exchanging partially hydrogenated fat for palmitic acid in the diet increases LDL-cholesterol and endogenous cholesterol synthesis in normocholesterolemic women ( abstract ), in Eur. J. Nutr. , vol. 42, 2003, pp. 188-194, PMID 12923649 .
- ^ ( EN ) MF Fernandez, Mechanisms by which Dietary Fatty Acids Modulate Plasma Lipids , in J. Nutr. , vol. 135, 2005, pp. 2075–2078, PMID 16140878 .
- ^ ( EN ) MJ Mazier, Diet fat saturation and feeding state modulate rates of cholesterol synthesis in normolipidemic men , in J. Nutr. , vol. 127, 1997, pp. 332-340, PMID 9039836 . URL consultato il 17/06/2018 .
- ^ ( EN ) SL Cook, Palmitic acid effect on lipoprotein profiles and endogenous cholesterol synthesis or clearance in humans ( PDF ), in Asia Pacific J. Clin. Nutr. , vol. 6, 1997, pp. 6-11, PMID 24394645 .
- ^ ( EN ) J. Zhang, Cholesterol metabolism and homeostasis in the brain , in Protein Cell. , vol. 6, 2015, pp. 254–264, PMID 25682154 .
- ^ ( EN ) RW Mahley, Central Nervous System Lipoproteins , in Atherosc. Thromb. Vasc. Biol , vol. 36, 2016, pp. 1305-1315, PMID 27174096 .
- ^ ( EN ) YH Hung, Links between copper and cholesterol in Alzheimer's disease , in Front. Physiol. , vol. 4, 2013, p. 111, PMC 3655288 .
- ^ ( EN ) X. Lin, Ezetimibe Increases Endogenous Cholesterol Excretion in Humans , in Atheroscl. Thromb. Vasc. Biol. , vol. 37, 2017, pp. 990-996, PMID 28279967 .
- ^ ( EN ) RE Temel, A New Model of Reverse Cholesterol Transport: EnTICEing Strategies to Stimulate Intestinal Cholesterol Excretion , in Trends Pharmacol. Sci. , vol. 36, 2015, pp. 440–451, PMID 25930707 .
- ^ ( EN ) KS Bura, Intestinal SR-BI does not impact cholesterol absorption or transintestinal cholesterol efflux in mice , in J. Lipid Res. , vol. 54, 2013, pp. 1567–1577, PMC 3646458 .
- ^ a b ( EN ) B. Genser, Plant sterols and cardiovascular disease: a systematic review and meta-analysis , in Eur. Heart J. , vol. 33, 2012, pp. 444-451, PMID 22334625 .
- ^ a b Fiocca , pp. 349-351 .
- ^ ( EN ) E. Sehayek, U-shaped relationship between change in dietary cholesterol absorption and plasma lipoprotein responsiveness and evidence for extreme interindividual variation in dietary cholesterol absorption in humans , in J. Lipid Res. , vol. 39, 1998, pp. 2415–2422, PMID 9831629 .
- ^ ( EN ) E. Sehayek, Genetic regulation of cholesterol absorption and plasma plant sterol levels: commonalities and differences , in J. Lipid Res. , vol. 44, 2003, pp. 2030-2038, PMID 12897193 .
- ^ ( EN ) Y. Yamanashi, Transporters for the Intestinal Absorption of Cholesterol, Vitamin E, and Vitamin K , in J. Atheroscler. Thromb. , vol. 24, 2017, pp. 347–359, PMID 28100881 .
- ^ ( EN ) RE Ostlund Jr., Cholesterol absorption efficiency declines at moderate dietary doses in normal human subjects , in J. Lipid Res. , vol. 40, 1999, pp. 1453-1458, PMID 10428981 .
- ^ a b ( EN ) DJ McNamara,Heterogeneity of cholesterol homeostasis in man. response to changes in dietary fat quality and cholesterol quantity , in J. Clin. Invest. , vol. 79, 1987, pp. 1729–1739, PMC 424515 .
- ^ ( EN ) E. Quintao, Effects of dietary cholesterol on the regulation of total body cholesterol in man , in J. Lipid Res. , vol. 12, 1971, pp. 233-247, PMID 5108133 .
- ^ ( EN ) F.Jr. Kern, Normal Plasma Cholesterol in an 88-Year-Old Man Who Eats 25 Eggs a Day — Mechanisms of Adaptation , in N. Engl. J. Med. , vol. 324, 1991, pp. 896-899, PMID 1953841 .
- ^ a b ( EN ) J. Iqbal, Intestinal lipid absorption , in Am. J. Physiol. Endocrinol. Metab. , vol. 296, 2009, pp. E1183–E1194, PMID 19158321 .
- ^ ( EN ) HH Wang, Lack of the intestinal Muc1 mucin impairs cholesterol uptake and absorption but not fatty acid uptake in Muc1-/- mice , in Am. J. Physiol. , vol. 287, 2004, pp. G547-554, PMID 15075252 (archiviato dall' url originale il 10 ottobre 2017) .
- ^ ( EN ) A. BR. Thomson, Recent advances in small bowel diseases: Part II ( PDF ), in World J. Gastroenterol. , vol. 18, 2012, pp. 3353–3374, PMID 22807605 .
- ^ ( EN ) L. Jia, Niemann-Pick C1-Like 1 (NPC1L1) Protein in Intestinal and Hepatic Cholesterol Transport , in Ann. Rev. Physiol. , vol. 73, 2011, pp. 239–259, PMID 20809793 .
- ^ ( EN ) JL Betters, NPC1L1 and Cholesterol Transport , in FEBS Lett. , vol. 584, 2010, pp. 2740–2747, PMID 20307540 .
- ^ ( EN ) NA Abumrad, Role of the gut in lipid homeostasis , in Physiol. Rev. , vol. 92, 2012, pp. 1061–1085, PMID 22811425 .
- ^ ( EN ) JH. Zhang, The N-terminal Domain of NPC1L1 Protein Binds Cholesterol and Plays Essential Roles in Cholesterol Uptake , in J. Biol. Chem. , vol. 286, 2011, pp. 25088–25097, PMID 21602275 .
- ^ ( EN ) L. Ge, Flotillins play an essential role in Niemann-Pick C1-like 1-mediated cholesterol uptake , in Proc. Natl. Acad. Sci. USA , vol. 108, 2011, pp. 551-556, PMID 21187433 .
- ^ ( EN ) M. Meister, Endocytic Trafficking of Membrane-Bound Cargo: A Flotillin Point of View , in Membranes (Basel) , vol. 4, 2014, pp. 356–371, PMID 25019426 .
- ^ ( EN ) RS Tilvis, Serum plant sterols and their relation to cholesterol absorption , in Am. J. Clin. Nutr. , vol. 43, 1986, pp. 92-97.
- ^ ( EN ) L. Jakulj, Plasma plant sterols serve as poor markers of cholesterol absorption in man , in J. Lipid Res. , vol. 54, 2013, pp. 1144-1150, PMID 23178226 .
- ^ ( EN ) P. Mistry,Individual variation in the effects of dietary cholesterol on plasma lipoproteins and cellular cholesterol homeostasis in man: studies of low density lipoprotein receptor activity and 3-hydroxy-3-methylglutaryl coenzyme A reductase activity in blood mononuclear cells , in J. Clin. Invest. , vol. 67, 1981, pp. 493–502, PMID 6257763 .
- ^ ( EN ) A. Mazein, A comprehensive machine-readable view of the mammalian cholesterol biosynthesis pathway [ collegamento interrotto ] , in Biochem. Pharmacol. , vol. 86, 2013, pp. 56–66, PMID 23583456 .
- ^ Nelson , pp.860-870 .
- ^ ( EN ) H. Jingami, Partial deletion of membrane-bound domain of 3-hydroxy-3-methylglutaryl coenzyme A reductase eliminates sterol-enhanced degradation and prevents formation of crystalloid endoplasmic reticulum ( abstract ), in J. Cell Biol. , vol. 104, 1987, pp. 1693-1704, PMID 3584246 .
- ^ ( EN ) SK Banerjee, Effect of garlic on cardiovascular disorders: a review ( PDF ), in Nutr. J. , vol. 1, n. 4, 2002, PMID 12537594 .
- ^ ( EN ) GC Ness, Feedback and hormonal regulation of hepatic 3-hydroxy-3-methylglutaryl coenzyme A reductase: the concept of cholesterol buffering capacity ( abstract ), in Proc. Soc. Exp. Biol. Med. , vol. 224, 2000, pp. 8-19, PMID 10782041 .
- ^ ( EN ) GC Ness, Insulin and glucagon modulate hepatic 3-hydroxy-3-methylglutaryl-coenzyme A reductase activity by affecting immunoreactive protein levels ( PDF ), in J. Biol. Chem. , vol. 269, 1994, pp. 29168-29172, PMID 7961882 .
- ^ ( EN ) GC Ness, Involvement of tristetraprolin in transcriptional activation of hepatic 3-hydroxy-3-methylglutaryl coenzyme A reductase by insulin , in Biochem. Biophys. Res. Commun. , vol. 420, 2012, pp. 178-182, PMID 22405826 .
- ^ ( EN ) TA. Miettinen, Effect of statins on noncholesterol sterol levels: implications for use of plant stanols and sterols ( abstract ), in Am. J. Cardiol , 96(1A), 2005, pp. 40D-46D, PMID 15992515 .
- ^ ( EN ) NR Matthan, Sex‐Specific Differences in the Predictive Value of Cholesterol Homeostasis Markers and 10‐Year Cardiovascular Disease Event Rate in Framingham Offspring Study Participants ( PDF ), in J. Am. Heart Assoc. , vol. 2, 2013, p. e005066, PMID 23525441 .
- ^ ( EN ) MR. Hoenig, Cholestanol: a serum marker to guide LDL cholesterol-lowering therapy ( abstract ), in Atherosclerosis , vol. 184, 2006, pp. 247-254, PMID 16216250 .
- ^ ( EN ) M. Witsch-Baumgartner, Birthday of a syndrome: 50 years anniversary of Smith-Lemli-Opitz Syndrome. , in Eur. J. Hum. Genet , vol. 23, 2015, pp. 277-278, PMID 24824134 .
- ^ ( EN ) MW King, S. Marchesini, Lipid digestion and Lipoproteins , su themedicalbiochemistrypage.org , 21 novembre 2008. URL consultato il 25 novembre 2008 .
- ^ Goldman , p.1395 .
- ^ a b Robertson , pp.25-27 .
- ^ Goldman , p.2713 .
- ^ ( EN ) AL Catapano et al. , 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias , in European Heart Journal , 27 agosto 2016, pp. 2999-3058, DOI : 10.1093/eurheartj/ehw272 . URL consultato il 31 agosto 2016 .
- ^ a b MM Gulizia, Colesterolo e rischio cardiovascolare: percorso diagnostico-terapeutico in Italia ( PDF ), in G. Ital. Cardiol. , 17 (Suppl. 1), 2016, p. S6, DOI : 10.1714/2264.24358 .
- ^ DL Kasper , pp. 2240-2442 .
- ^ a b ( EN ) Y. Oztas, Hypocholesterolemia: A Neglected Laboratory Finding ( abstract ), in Acta Medica , vol. 4, 2015.
- ^ a b ( EN ) D. Rzman, Perspectives of the non-statin hypolipidemic agents ( abstract ), in Pharmacol. Therap. , vol. 127, 2010, pp. 19–40, PMID 20420853 .
- ^ ( EN ) HR Davis, Zetia: inhibition of Niemann-Pick C1 Like 1 (NPC1L1) to reduce intestinal cholesterol absorption and treat hyperlipidemia , in J. Atheroscler. Thromb. , vol. 14, 2007, pp. 99-108, PMID 17587760 .
- ^ Brunton , p.113 .
- ^ ( EN ) R. Collins, Interpretation of the evidence for the efficacy and safety of statin therapy ( PDF ), in Lancet , vol. 388, 2016, pp. 2532–2561, DOI : 10.1007/s11883-016-0611-4 .
- ^ ( EN ) O. Bilen, Bempedoic Acid (ETC-1002): an Investigational Inhibitor of ATP Citrate Lyase ( PDF ), in Curr. Atheroscler. Rep. , vol. 18, 2016, p. 61, PMC 5035316 .
- ^ ( EN ) VC Menys, Squalene synthase inhibitors , in Br. J. Pharmacol. , vol. 139, 2003, pp. 881-882, PMC 1573925 .
- ^ ( EN ) L. Trapani, Potential role of nonstatin cholesterol lowering agents , in IUBMB Life , vol. 63, 2011, pp. 964-971, DOI : 10.1002/iub.522/epdf .
- ^ a b ( EN ) PJ Barter, New Era of Lipid-Lowering Drugs , in Pharmacol Rev. , vol. 68, 2016, pp. 458-475, DOI : 10.1124/pr.115.012203 .
- ^ ( EN ) D. Moßhammer, Mechanisms and assessment of statin-related muscular adverse effects , in Br. J. Clin. Pharmacol. , vol. 78, 2014, pp. 454–466, PMC 4243897 .
- ^ ( EN ) P. Cao, Statin-induced muscle damage and atrogin-1 induction is the result of a geranylgeranylation defect , in FASEB J. , vol. 23, 2009, pp. 2844-2854, PMC 2735363 .
- ^ ( EN ) D. Rader,Lomitapide and Mipomersen , in Circ. , vol. 129, 2014, pp. 1022-1032, DOI : 10.1161/CIRCULATIONAHA.113.001292 .
- ^ ( EN ) T. Yamamoto, Development of Antisense Drugs for Dyslipidemia , in J. Atheroscler. Thromb. , vol. 23, 2016, pp. 1011–1025, PMC 5090806 .
- ^ AIFA. Agenzia italiana del farmaco , su aifa.gov.it . URL consultato il 12 febbraio 2018 (archiviato dall' url originale il 13 febbraio 2018) .
- ^ ( EN ) SC Goulooze, Lomitapide , in Br. J. Clin. Pharmacol. , vol. 80, 2015, pp. 179-181, DOI : 10.1111/bcp.12612 .
- ^ Scheda tecnica Lojuxta ( PDF ).
- ^ ( EN ) G. Reyes-Soffer, Complex effects of inhibiting hepatic apolipoprotein B100 synthesis in humans , in Sci. Transl. Med. , vol. 8, n. 323, 2016, PMC 4944115 .
- ^ ( EN ) TD Filippatos, Anacetrapib, a New CETP Inhibitor: The New Tool for the Management of Dyslipidemias? ( PDF ), in Diseases , vol. 5, 2017, p. 21, PMC 5750532 .
- ^ ( EN ) AR Tall, Trials and Tribulations of CETP Inhibitors , in Circ. Res. , vol. 122, 2018, pp. 106-112, DOI : 10.1161/CIRCRESAHA.117.311978 .
- ^ ( EN ) R. Chaudhary, PCSK9 inhibitors: A new era of lipid lowering therapy , in World J. Cardiol. , vol. 9, 2017, pp. 76-91, PMC 5329749 .
- ^ ( EN ) MS Sabatine, Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease , in New Engl. J. Med. , vol. 376, 2017, pp. 1713-1722, DOI : 10.1056/NEJMoa1615664 .
- ^ Fitzgerald K, White S, Borodovsky A, Bettencourt BR, Strahs A, Clausen V, Wijngaard P, Horton JD, Taubel J, Brooks A, Fernando C, Kauffman RS, Kallend D, Vaishnaw A, Simon A,A Highly Durable RNAi Therapeutic Inhibitor of PCSK9 , in The New England Journal of Medicine , vol. 376, n. 1, gennaio 2017, pp. 41–51, DOI : 10.1056/NEJMoa1609243 , PMC 5778873 , PMID 27959715 .
- ^ ( EN ) V. Charlton‐Menys, Human cholesterol metabolism and therapeutic molecules , in Experim. Physiol. , vol. 93, 2008, pp. 27–42, DOI : 10.1113/expphysiol.2006.035147 .
- ^ ( EN ) H. Bays, Colesevelam hydrochloride: reducing atherosclerotic coronary heart disease risk factors , in Vasc. Health Risk Manag. , vol. 3, 2007, pp. 733–742, PMC 2291317 .
- ^ ( EN ) H. Vosper, Niacin: a re-emerging pharmaceutical for the treatment of dyslipidaemia , in Br. J. Pharmacol. , vol. 158, 2009, pp. 429–441, PMC 2757682 .
- ^ ( EN ) ET Bodor, Nicotinic acid: an old drug with a promising future , in Br. J. Pharmacol. , 153(Suppl 1), 2008, pp. S68–S75, PMC 2268066 .
- ^ ( EN ) RL Dunbar, Niacin Alternatives for Dyslipidemia: Fool's Gold or Gold Mine? Part I: Alternative Niacin Regimens ( PDF ), in Curr. Atheroscler. Rep. , vol. 18, 2016, p. 11, PMC 4753247 .
- ^ ( EN ) RL Dunbar, Niacin Alternatives for Dyslipidemia: Fool's Gold or Gold Mine? Part II: Novel Niacin Mimetics ( PDF ), in Curr. Atheroscler. Rep. , vol. 18, 2016, p. 17, PMC 4773474 .
Bibliografia
- ( EN ) LL Brunton, Goodman & Gilman's The pharamacological basis of therapeutics , 12ª ed., McGraw-Hill, 2011, ISBN 978-0-07-162442-8 .
- E. Ferroni, Enciclopedia della chimica , vol. 3, Firenze, USES, 1974, ISBN 88-03-00066-6 .
- Silvio Fiocca et al. , Fondamenti di anatomia e fisiologia umana , 2ª ed., Napoli, Sorbona, 2000, ISBN 88-7150-024-5 .
- M. Friedman e GW Friedland, Le 10 più grandi scoperte della medicina , traduzione di N. Colombi, Milano, Baldini & Castoldi, 2000, ISBN 88-8089-844-2 .
- ( EN ) L. Goldman e AI Schafer, Goldman-Cecil Medicine , 25ª ed., Philadelphia, Elsevier-Saunders, 2016, ISBN 978-1-4557-5017-7 .
- ( EN ) DL Kasper, Harrison's Principles of internal medicine , 19ª ed., McGraw-Hill, 2015, ISBN 978-0-07-180216-1 .
- ( EN ) E. Kuntz,Hepatology , 2ª ed., Heidelberg, Springer Medizin Verlag, 2006, ISBN 3-540-28976-3 .
- ( EN ) J. McMurry, 27 , in Organic Chemistry , 8ª ed., Belmont, Brooks/Cole, 2012, ISBN 0-8400-5444-0 .
- ( EN ) DL Nelson, Lehninger Principles of biochemistry , 8ª ed., New York, WH Freeman & Company, 2013, ISBN 978-1-4641-0962-1 .
- ( EN ) D. Puri, Textbook of medical biochemistry , 3ª ed., Elsevier, 2011, ISBN 978-81-312-2312-3 .
- ( EN ) J. Rodès, Textbook of hepatology , 3ª ed., Oxford, Blackwell publishing, 2007, ISBN 978-1-4051-2741-7 .
- ( EN ) A. Robertson et al. , Food and health in Europe: a new basis for action ( PDF ), WHO Regional Publications - European Series N° 96, WHO, 2004, ISBN 92-890-1363-X .
- ( EN ) L. Stryer, capitolo 26 , in Biochemistry , 5ª ed., New York, WH Freeman, 2002, ISBN 0-7167-3051-0 .
- EP Widmaier et al. , 3 , in Vander Fisiologia , Milano, CEA, 2011, ISBN 978-88-08-18510-5 .
Voci correlate
Altri progetti
-
 Wikiquote contiene citazioni sul colesterolo
Wikiquote contiene citazioni sul colesterolo -
 Wikizionario contiene il lemma di dizionario « colesterolo »
Wikizionario contiene il lemma di dizionario « colesterolo » -
 Wikimedia Commons contiene immagini o altri file sul colesterolo
Wikimedia Commons contiene immagini o altri file sul colesterolo
Collegamenti esterni
- colesterolo , su Treccani.it – Enciclopedie on line , Istituto dell'Enciclopedia Italiana .
- ( EN )Medical Crossfire - Lipid/Metabolic , su theheart.org . URL consultato il 25 novembre 2008 .
- ( EN ) Medical Crossfire - Hot Topics in Hypercholesterolemia: Impact of Recent Clinical Trial Data on Clinical Practice , su theheart.org . URL consultato il 25 novembre 2008 .
- E. Muritti, G. Pavone, Chi ha paura del colesterolo? , su Repubblica .it , 8 aprile 2013. URL consultato il 31 Marzo 2018 ( archiviato il 20 aprile 2013) .
« Philippe Even ; Cesare Fiorentini; Michel de Lorgeril .» . - U. Ravnskov, Md, PhD, Presunti benefici del colesterolo contro le infezioni da batteri , su westonaprice.org , 24 giugno 2004. URL consultato il 31 marzo 2018 ( archiviato l'11 luglio 2017) .
| Controllo di autorità | Thesaurus BNCF 20899 · LCCN ( EN ) sh85024654 · GND ( DE ) 4010034-0 · BNF ( FR ) cb11931193t (data) · NDL ( EN , JA ) 00566626 |
|---|