Triiodotironină
| Triiodotironină | |
|---|---|
| Numele IUPAC | |
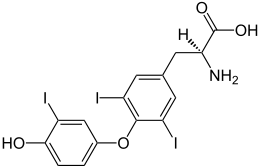
| Acid (2 S ) -2-amino-3- [4- (4-hidroxi-3-iodofenoxi) -3,5-diiodofenil] propanoic { nume sistematic = O- (4-hidroxi-3-iodofenil) -3,5-diiodo-L-tirozină} | |
| Abrevieri | |
| T 3 | |
| Denumiri alternative | |
| Liotironină | |
| Caracteristici generale | |
| Formula moleculară sau brută | C 15 H 12 I 3 NO 4 |
| Masa moleculară ( u ) | 650,9776 g / mol |
| numar CAS | |
| Numărul EINECS | 229-999-3 |
| PubChem | 5920 |
| DrugBank | DB00279 |
| ZÂMBETE | C1=CC(=C(C=C1OC2=C(C=C(C=C2I)CC(C(=O)O)N)I)I)O |
| Informații de siguranță | |
Triiodotironina (T 3 ) este un hormon tiroidian , produs de glanda endocrină tiroidiană împreună cu tiroxina .
Conține trei atomi de iod și este prezent în fluxul sanguin cu o concentrație de 80/180 ng / dl de sânge . În țesuturile periferice, tiroxina se transformă în triiodotironină.
Biosinteza și secreția de triiodotironină
Procesul de biosinteză a triiodotironinei implică următoarele fenomene:
- Absorbție activă de iodură prin intermediul cotransportatorilor de membrană ai celulei foliculare tiroidiene , direcționând iodura către partea apicală a celulei și transportându-se prin membrana apicală către lumenul folicular
- Oxidarea iodurii în lumenul folicular
- Iodarea reziduurilor de tirozil ale moleculei de tiroglobulină , cu formarea de iodotirozine
- Cuplarea oxidativă a două iodotirozine, producând iodotironine încă legate de tiroglobulină.
Tiroida captează iodura circulantă printr-un proces activ care necesită energie. Acest proces de absorbție este realizat de proteina NIS ( Sodium Iodide Symporter ), care folosește energia electrochimică a sodiului intracelular.
Proteina NIS transportă ioni de sodiu (Na +) și iod (I-) în celulă într-un raport 2: 1. Activitatea Na + / K + ATPaza garantează energia electrochimică necesară pentru intrarea iodurii, prin transportul activ de sodiu în afara celulei împotriva gradientului său electrochimic, necesitând o cheltuială de ATP . Acest transport de iodură este inhibat de ioni precum perclorat , tiocianat și pertecnetat .
Odată ajuns în interiorul celulei, iodura difuzează spre partea apicală către lumenul foliculului tiroidian , fiind transportată peste membrana apicală prin intermediul proteinei pendrin (PDS).
Iodura este oxidată în cele din urmă de peroxidaza de iodură (TPO), o enzimă situată pe membrana apicală, care are situl catalitic în interiorul lumenului folicular. Procesul de oxidare folosește peroxidul de hidrogen (H 2 O 2 ) ca donator de electroni, generat de enzima membranei apicale DUOX .
După oxidare, iodura va fi încorporată în reziduurile de tirozină ale moleculei de tiroglobulină. Când un radical de iod este încorporat în tirozină, se produce o monoiodotirozină (MIT). Pe de altă parte, atunci când doi radicali de iod sunt încorporați în tirozină, se produce o diiodotirozină (DIT).
Cuplarea reziduurilor de tirozil ale tiroglobulinei, care are loc după organizarea iodurii, este, de asemenea, catalizată de TPO. Încă legate de tiroglobulină, unele tirozine (MIT și DIT) se împerechează, producând iodotironine. Cuplarea unui MIT cu un DIT produce triiodotironină (T 3 ) sau rT 3 ( triiodotironină inversă , care nu este activă din punct de vedere biologic, deoarece unul dintre radicalii de iod nu este legat de carbonul 5 al moleculei, ci de carbonul 5 '). Cuplarea a două DIT produce tetraiodotironină , un alt hormon al glandei tiroide (T 4 ). Două MIT produc diiodotironină, care, ca și rT 3, nu are activitate biologică.
Coloidul lumenului folicular, care conține iodotironine încă legate de tiroglobulină, este endocitat de celula foliculară prin procesul de pinocitoză . Prin urmare, în citoplasmă , veziculele coloidale endocitate se fuzionează cu lizozomi cu enzime de activitate proteolitică , care hidrolizează tiroglobulina, eliberând molecule libere de T 4 , T 3 , rT 3 , diiodotironină, MIT și DIT. Deoarece aceste ultime trei molecule nu posedă activitate biologică, își pierd radicalii de iod datorită acțiunii enzimei DHAL în citoplasmă.
Aproximativ 10% din T 4 produsă de celula foliculară este convertită în T 3 prin activitatea enzimei 5'-deiodază aflată încă în citoplasmă.
Celulele foliculare exprimă un transportor aparținând familiei transportorilor de monocarboxilat (MCT) la nivelul membranei bazalo-laterale. În cazul tirocitelor, acest transportor este denumit MCT8. Date recente indică faptul că MCT8 este implicat în secreția hormonilor tiroidieni circulanți.
Transportul triiodotironinei în sânge
Concentrația totală de triiodotironină în sânge este de 2,3 nmol / L. Cu toate acestea, o mică parte se găsește liberă în plasmă (fT 3 ), deoarece cea mai mare parte a hormonului este legată de proteinele plasmatice, cum ar fi proteina de legare a tiroxinei (TBG), transtiretina (TTR), albumina și lipoproteinele .
Fiind un echilibru chimic, exprimat prin formula:
constanta poate fi definită:
Prin urmare, concentrația liberă de T 3 va fi:
Metabolismul periferic al triiodotironinei
Glanda tiroidă produce cantități mai mari de tiroxină decât triiodotironina. Triiodotironina este, de asemenea, metabolică mai activă. Astfel, în țesuturile periferice tiroxina se transformă în triiodotironină (80% din triiodotironină este produsă de tiroxină periferic și 20% este produsă în glanda tiroidă).
Transformarea tiroxinei în triiodotironină are loc datorită deiodazelor , enzime care conțin selenocisteină și care elimină radicalul de iod al tiroxinei, producând triiodotironină și triiodotironină inversă (în funcție de radicalul eliminat). Triiodotironina poate pierde și radicali de iod, devenind diiodotironină. Aceste mecanisme de producție a rT 3 și T 2 sunt realizate de deiodaza 3 (D3) și constituie o metodă de inactivare a T 3 atunci când nivelurile sale plasmatice sunt prea mari (în situații de hipertiroidism acest mecanism nu este suficient).
Din aceste informații, se concluzionează, prin urmare, că activitatea potențială a triiodotironinei nu se găsește în plasma T 3 (care este scăzută), ci în plasma T 4 , care constituie un „rezervor” de T 3 datorită acțiunii ulterioare a deiodazelor periferice. .
Lipsa de seleniu poate reduce activitatea deiodazelor. Propiltiouracilul inhibă, de asemenea , diiodazele, provocând hipotiroidism .
Absorbția celulelor de triiodotironină
Absorbția celulelor de triiodotironină se realizează de către transportorii de membrană. Există două familii ale acestor transportoare: „ transportoare de anioni organici ” și „ transportoare de aminoacizi ”.
Familia transportorilor de aminoacizi care transportă iodotironine prezintă un interes medical deosebit, deoarece sunt formate din două reziduuri ale aminoacizilor tirozină. Transportorul de aminoacizi responsabil pentru această acțiune este MCT8 ( transportor de monocarboxilat ), care transportă aminoacizi aromatici , cum ar fi tirozina.
În sistemul nervos , acțiunea MCT8 are o mare importanță pentru neuroni, deoarece acest tip de celulă nu are deiodaza D2 pe membrană și absorbția triiodotironinei are loc datorită acțiunii D2 a astrocitelor . MCT8 este, prin urmare, esențial pentru absorbția neuronală a triiodotironinei convertite de astrocit. O mutație a acestui transportor provoacă un sindrom legat de X caracterizat prin întârziere psihomotorie severă și niveluri ridicate de T 3 plasmatică, sindromul Allan-Herndon-Dudley [1] .
Reglarea sintezei triiodotironinei
De la TSH
Hormonul TSH , produs în hipofiză este principalul regulator al activității tiroidiene. Cu toate acestea, TSH este, de asemenea, reglementat de hormonul hipotalamicTRH (TSH Releasing Hormone), constituind un mecanism de feedback negativ.
Acest mecanism se explică prin reacția celulelor hipofizare producătoare de TSH la modificările hormonilor tiroidieni din sânge. Când nivelurile sunt scăzute, există o sinteză mai mare a receptorilor TRH din aceste celule, receptivitatea la TRH crește și, prin urmare, se produce mai mult TSH. Inversul se întâmplă atunci când nivelurile plasmatice ale hormonilor tiroidieni sunt ridicate.
Deoarece expresia receptorilor TSH și TRH este reglată de nivelurile intracelulare ale triiodotironinei, nivelurile plasmatice ale tiroxinei au un efect mai puternic asupra acestei reglări, deoarece tiroxina plasmatică este resursa fundamentală a triiodotironinei intracelulare (80% din total), datorită acțiunea deiodinazei D2 a celulei hipofizare . Prin urmare, nivelurile de tiroxină plasmatică sunt foarte importante pentru clinică.
TSH acționează direct asupra celulei foliculare a tiroidei, promovând creșterea, proliferarea și activitatea acesteia. Receptorii TSH din celula foliculară, prin transducția semnalului și acțiunea proteinei G , cresc nivelurile plasmatice ale AMP ciclic . Transportorul NIS și genele tiroglobulinei au situsuri de reglare mediate de nivelurile ciclice de AMP, iar atunci când sunt crescute, sinteza NIS și a tiroglobulinei este crescută. Astfel, TSH crește activitatea enzimelor responsabile de sinteza hormonilor tiroidieni.
De la nivelurile intracelulare ale iodului organizat
Mecanismul de autoreglare a sintezei triiodotironinei se datorează reacției celulei foliculare la nivelurile intracelulare ale iodului organizat. Iodul organizat intracelular inhibă activitatea enzimei DUOX, care furnizează apă oxigenată oxidării iodurii [2] . Astfel, sinteza iodului organizat scade. Când nivelurile plasmatice de iodură sunt ridicate, acestea determină un efect scăzut al sintezei hormonilor tiroidieni, efectul Wolff-Chaikoff .
Efectul Wolff-Chaikoff durează câteva zile, după care efectul se termină atunci când sinteza hormonilor revine la normal.
Mecanismul molecular de acțiune
Genomică
Acțiunea genomică a triiodotironinei promovează modificarea expresiei genice a celulei țintă. T 3 provine din sânge sau din metabolismul intracelular al tiroxinei de către deiodinaze. Receptorul hormonului tiroidian (TR) este nuclear și se cuplează la regiunile reglatoare ale genei țintă. Aceste regiuni sunt numite TREI (din elementul englez care răspunde la hormonul tiroidian ).
Receptorul TR se leagă de ADN - ul genei țintă ca monomer , homodimer sau chiar heterodimer. Situația principală este formarea heterodimerului TR cu receptorul nuclear RXR (din receptorul retinoid X englez, receptorul retinoid X ). TR poate forma în continuare heterodimeri cu alți receptori. Cu toate acestea, cel mai stabil complex cu cea mai mare afinitate pentru regiunile TRE este complexul TR-RXR.
Triiodotironina generează diferite semnale celulare care depind de gene și țesuturi, reglând atât activarea, cât și reprimarea transcrierii ARNm .
Reprimarea transcripției în absența triiodotironinei
Legătura chimică a TR cu regiunile TRE ale ADN-ului are loc independent de prezența triiodotironinei. Multe proteine reglatoare se leagă de homodimerul TR-TR sau de heterodimerul TR-RXR, cum ar fi proteina HDAC ( histon deacetilază ). Acest complex represor promovează deacetilarea histonelor , făcând cromatina compactă și inhibând astfel acțiunea enzimei de transcripție ARN polimerază .
Reprimarea transcripției în prezența triiodotironinei
Prezența triiodotironinei poate reprima și transcrierea unor gene. Acest fenomen este important în hipotalamus și glanda pituitară pentru a asigura feedback-ul negativ care reglează secreția de triiodotironină: reprimarea transcripției este esențială pentru scăderea secreției de TSH și TRH atunci când nivelurile hormonilor tiroidieni sunt doar mari.
Procesul de reprimare verificat în acest mecanism de feedback este realizat de receptorul TRβ2, care este exprimat de celulele hipotalamice și hipofizare implicate în procesul de reglare a activității tiroidei. Prin urmare, receptorul TRβ scade transcripția atunci când este legat de triiodotironină [3] .
Activarea transcrierii în prezența triiodotironinei
Când triiodotironina se leagă de TR (cu excepția tipurilor de TR implicate în reglarea sintezei hormonilor tiroidieni, TRβ2), activează transcripția ARNm. Acest lucru se întâmplă deoarece în prezența T 3 complexul represor este inactivat. Rolul proteinelor co-activatoare este important în acest fenomen, fiind principalele proteine din familia TRAP ( Proteinele asociate cu receptorul hormonului tiroidian, adică proteinele asociate cu receptorul hormonului tiroidian) și din familia SRC ( co-activatorul receptorilor steroizi , adică activator al receptorilor de steroizi ). Acestea din urmă cresc transcripția mediată nu numai de receptorii steroizi, ci și de alți receptori, cum ar fi TR.
Interacțiunea dintre SRC-1 și proteinele din familia co-activatorului p300-CBP promovează acetilarea histonelor . Această reacție chimică face cromatina accesibilă ARN polimerazei, favorizând transcripția [4] .
Probleme în mecanismul genomic
Mutațiile receptorilor TR pot provoca rezistență la hormonii tiroidieni. Când mutația apare în receptori exprimați de diferite țesuturi (cum ar fi TRα), imaginea este de hipotiroidism , deoarece receptorii TRα nu sunt în măsură să regleze transcripția chiar și atunci când nivelurile ridicate de hormoni tiroidieni se găsesc în sânge (rezistență periferică). Cu toate acestea, atunci când mutația apare la nivelul receptorilor, exprimată doar de hipotalamus și hipofiză, există o situație de hipertiroidism , deoarece receptorii (TRβ2) nu sunt capabili să inhibe sinteza TRH și TSH chiar și atunci când nivelurile ridicate de hormoni tiroidieni în sânge (rezistență la hipofiza) [5] .
Nu genomică
Triiodotironina are, de asemenea, mecanisme de acțiune non-genomice care, prin urmare, nu implică reglarea expresiei genelor. Acest mecanism de acțiune apare datorită interacțiunii dintre triiodotironină și unele proteine ale membranei celulare și membranei mitocondriale, care reglează, de exemplu, traficul ADP și ATP din interiorul mitocondriei .
Efecte biologice intracelulare
Produse din activitatea genomică
Triiodotironina promovează transcrierea mai multor enzime implicate în metabolism, în special metabolismul respirator . Enzimele care joacă un rol important în lanțul de transport al electronilor , precum NADPH-citocrom-c2 reductaza , citocrom-c oxidaza au o sinteză ridicată în prezența hormonilor tiroidieni și, prin urmare, cresc rata respirației celulare datorită activităților lor crescute .
Alte produse ale activității genomice a triiodotironinei sunt: glicerol-3-fosfat dehidrogenază , enzimă malică , eritropoietină , proteină G stimulatoare etc.
De asemenea, crește nivelurile de UCP în mitocondrie, o puternică decuplare a lanțului respirator de fosforilarea oxidativă, provocând producția de căldură și nu de ATP ca urmare a respirației.
Nu genomică
Unele efecte non-genomice sunt observate în prezența triiodotironinei în celulă. Aceste efecte sunt cauzate de interacțiunea cu proteinele care nu sunt implicate în exprimarea genelor.
Ca urmare, crește activitatea unor proteine importante pentru metabolismul celular, cum ar fi unii transportori de ioni (în special pompa de sodiu-potasiu) și calmodulina . Există și alte efecte: creșterea absorbției de glucoză și controlul absorbției de calciu și remodelarea actinei , modificând citoscheletul multor celule.
Efecte biologice sistemice
În țesături individuale
Efecte în țesutul cardiac
Multe dintre efectele triiodotironinei, în special în sistemul cardiac, sunt similare cu cele produse de catecolamine . T 3 prezintă un mare efect inotrop și cronotrop în inimă. Excesul de T 3 crește capacitatea de reacție adrenergică cardiacă. Antagoniștii receptorilor Β-adrenergici inversează unele dintre efectele cardiace ale hipertiroidismului clinic, cum ar fi tahicardia , însă nu reușesc să inverseze alte efecte ale hipertiroidismului. T 3 promovează expresia crescută a proteinei structurale miozinei MHCα, rezultând o rată crescută de contracție cardiacă.
Ca efect general al acestor fenomene, se observă o creștere a debitului cardiac care garantează un aport de oxigen adecvat cererii mai mari din țesuturi care se observă în prezența triiodotironinei. Această creștere a debitului cardiac este cauzată atât indirect de triiodotironină (prin creșterea acțiunii catecolaminelor), cât și direct (prin creșterea expresiei miozinei MHCα, o absorbție mai mare de calciu de către miocit și creșterea activității adenilat ciclazei , fenomene care măresc forța de contracție).
Pentru funcția normală a inimii sunt necesare niveluri adecvate de hormoni tiroidieni. În cazurile de deficit de hormon tiroidian, ambele debituri cardiace sunt mai mici ca eficiență cardiacă, deoarece fracția de ejecție a ventriculului stâng este mai mică (raportul dintre cantitatea de sânge expulzat la sfârșitul sistolei și cantitatea totală de sânge care a fost în ventricul la începutul sistolei).
Efecte în țesutul nervos
Deficitul de triiodotironină în timpul dezvoltării embrionare și în copilărie determină o reducere a creșterii cortexului cerebral și cerebelos , proliferarea axonului , migrația celulară, mielinizarea , ramificarea dendritelor și geneza sinapselor . Ca urmare, această deficiență în primele etape ale vieții determină o întârziere în dezvoltarea sistemului nervos urmată de un deficit cognitiv și motor. Acest tablou clinic se numește cretinism .
Imaginile tomografice cu emisie de pozitroni ale creierului au arătat că, atunci când nivelurile de triiodotironină sunt reduse, fluxul sanguin către creier și metabolismul glucozei cerebrale sunt, de asemenea, mai mici. Aceste date pot explica deficitul psihomotor al indivizilor hipoterotici. [6]
Hormonul tiroidian crește, de asemenea, viteza și amplitudinea reflexelor nervoase periferice, vigilența și reacția la diferiți stimuli, memorie și capacitatea de învățare.
Efecte în țesutul osos
Osificarea endocondrală este stimulată de triiodotironină, făcând țesutul osos mai lung liniar prin maturarea centrelor osoase epifizare . Deși nu este necesară creșterea liniară a oaselor după naștere, triiodotironina este esențială pentru buna dezvoltare a oaselor fetale .
Triiodotironina participă, de asemenea, la remodelarea oaselor la adulți, iar excesul acesteia poate provoca osteoporoză .
Efecte în țesuturile pielii
Triiodotironina participă, de asemenea, la maturarea epidermei și a anexelor cutanate. Procesul de degradare a acestor structuri este promovat și de triiodotironină. Prin urmare, atât excesul, cât și deficiența acestui hormon, pot provoca probleme dermatologice.
Dermul suferă, de asemenea, de influența triiodotironinei, care inhibă sinteza și crește degradarea glicozaminoglicanilor , componente fundamentale ale matricei extracelulare dermice.
Efecte în sânge
Triiodotironina crește producția de eritropoietină și, prin urmare, crește hematopoieza . Hormonul crește, de asemenea, nivelurile de 2,3-bifosfoglicerat din eritrocite , promovând disocierea oxigenului de hemoglobină , crescând astfel disponibilitatea oxigenului liber în țesuturi. Acesta este un mecanism de compensare a cererii mai mari de oxigen promovată de triiodotironină.
Efecte în țesutul adipos
Maturarea pre-adipocitelor în adipocite este promovată de triiodotironină, care exercită diferite efecte asupra metabolismului lipidelor. Atât degradarea, cât și sinteza colesterolului sunt promovate de hormon. Cu toate acestea, deoarece degradarea suferă o acțiune tiroidiană mai mare, în stările de deficit de triiodotironină, nivelurile plasmatice ale colesterolului (asociate cu lipoproteinele cudensitate mică - LDL) sunt mai mari. Metabolismul colesterolului este crescut de hormonul tiroidian, de asemenea, datorită sintezei mai mari a receptorilor LDL de pe membrana celulară. Hormonul crește, de asemenea, lipoliza acizilor grași din țesutul adipos.
În termogeneză
Mamiferele sunt capabile să mențină o temperatură corporală constantă , chiar dacă temperatura externă suferă variații. Această abilitate implică generarea internă de căldură , un proces numit termogeneză obligatorie. În mediile termoneutrale , este suficientă termogeneza obligatorie. Cu toate acestea, în medii mai reci, este necesară activarea unui alt mecanism, termogeneza indusă de frig , care este inclusă în termogeneza facultativă. Triiodotironina reglează ambele mecanisme.
Acțiunea termogenă obligatorie a triiodotironinei are loc datorită activării expresiei proteinelor UCP . Proteinele UCP promovează revenirea protonilor prin spațiul intermembranar al membranei mitocondriale, fără activarea enzimei ATP sintetază și, prin urmare, fără a produce ATP. Acest flux de protoni disipă energia potențială chimică a protonilor sub formă de căldură. Triiodotironina crește, de asemenea, lipoliza , crescând disponibilitatea lipidelor , care sunt, de asemenea, fundamentale pentru acest proces de generare a căldurii, care se numește decuplare . Un alt mecanism de generare a căldurii în termogeneza obligatorie este hidroliza ATP de către ATPaze , a căror activitate este promovată de triiodotironină.
Termogeneza facultativă este activată de sistemul nervos simpatic datorită stimulilor externi, dar suferă o influență importantă din partea triiodotironinei. Animalele care suferă de deficit hormonal devin hipoterme în medii reci, deoarece un deficit de triiodotironină face ca aceste animale să nu poată susține răspunsul noradrenergic pentru generarea de căldură suplimentară (triiodotironina și catecolaminele au efecte sinergice).
Notă
- ^ https: // www.
- ^ Efectul iodurii asupra nicotinamidei adenine dinucleotide fosfat oxidază activitate și expresia proteinei Duox2 în foliculii tiroidieni porcini izolați
- ^ http://www.jbc.org/cgi/reprint/M511530200v1.pdf
- ^ http://www.pnas.org/content/96/5/1959.full.pdf
- ^ Rajhanshealthcare.com: RAJHANS HOSPITAL Arhivat 6 februarie 2009 la Internet Archive .
- ^ http://jcem.endojournals.org/cgi/reprint/86/8/3864.pdf [ link rupt ]
Bibliografie
- Laura Gandola. Sistem endocrin , în Invitația la biologie. A 5-a ed. Bologna, Zanichelli, 2004. p. 441. ISBN 8808055450 .
- Margarida de Mello Aires. Fiziologie . Ed. A 3-a Sao Paulo. Guanabara Koogan, 2008. p. 998-1014. ISBN 978-85-277-1368-9
- Berna, RM; Levy, MN; Koeppen, BM; Stanton, BA. Fiziologie . A 5-a ed. Rio de Janeiro. Elsevier, 2004 p. 915-937. ISBN 978-85-352-1367-6
Elemente conexe
Alte proiecte
-
 Wikționarul conține dicționarul lema « triiodotironină »
Wikționarul conține dicționarul lema « triiodotironină » -
 Wikimedia Commons conține imagini sau alte fișiere despre triiodotironină
Wikimedia Commons conține imagini sau alte fișiere despre triiodotironină
linkuri externe
- Boli ale glandei tiroide , pe wellness.com .
- [1]


![{\ displaystyle K = {\ frac {[TBG.T_ {3}]} {[fT_ {3}] [TBG]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fd039916e2f0d566b06e30b6344a1ead12adb059)
![{\ displaystyle fT_ {3} = {\ frac {[TBG.T_ {3}]} {[K] [TBG]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c84def8b2ee4d540406a5e38e734d120ce528faa)
