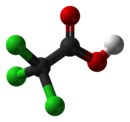
Acid tricloracetic
| Acid tricloracetic | |||
|---|---|---|---|
| Caracteristici generale | |||
| Formula moleculară sau brută | C 2 HCI 3 O 2 | ||
| Masa moleculară ( u ) | 163,39 g / mol | ||
| Aspect | solid incolor | ||
| numar CAS | |||
| Numărul EINECS | 200-927-2 | ||
| PubChem | 6421 | ||
| DrugBank | DB11152 | ||
| ZÂMBETE | C(=O)(C(Cl)(Cl)Cl)O | ||
| Proprietăți fizico-chimice | |||
| Constanta de disociere a acidului (pKa) la 298 K. | 0,7 | ||
| Solubilitate în apă | 1600 g / l (20 ° C) | ||
| Temperatură de topire | 54 ° C (327 K) | ||
| Temperatura de fierbere | 197 ° C (470 K) | ||
| Proprietăți termochimice | |||
| Δ f H 0 (kJ mol −1 ) | −503.3 | ||
| Informații de siguranță | |||
| Simboluri de pericol chimic | |||
  | |||
| Pericol | |||
| Fraze H | 314 - 335 - 410 | ||
| Sfaturi P | 273 - 280 - 301 + 330 + 331 - 305 + 351 + 338 - 309 + 310 [1] | ||
Acidul tricloracetic este un acid carboxilic cu formula CCl 3 COOH. La temperatura camerei apare ca un solid incolor cu miros înțepător. Este un compus coroziv . [2]
Sărurile sale se numesc tricloracetați .
Istorie
Acidul tricloracetic a fost descoperit de Jean-Baptiste Dumas în 1839. [3]
Sinteză
Acidul tricloracetic poate fi preparat prin reacția clorului gazos cu acidul acetic în prezența anhidridei acetice :
CH 3 COOH (s) + 3 Cl 2 (g) CCl 3 COOH (s) + 3 HCI (g)
Toxicologie
Acidul tricloracetic este un compus iritant , dăunător prin înghițire și în contact cu pielea. Provoacă iritația gâtului, tuse, dificultăți de respirație, cefalee, greață și vărsături dacă fumul este inhalat; iritarea stomacului și durerea abdominală în caz de înghițire, arsură și leziuni severe dacă sunt aduse în contact cu ochii și irită pielea, provocând roșeață sau răni. [4]
Proprietăți fizico-chimice
Structura sa este similară cu cea a unei molecule de acid acetic ai cărei trei atomi de hidrogen non-acizi au fost înlocuiți cu tot atâtea atomi de clor .
Acești trei atomi înlocuiți deplasează încărcătura electronică a carbonului α către ei înșiși, provocând o stare de deficiență parțială a electronilor asupra carbonului menționat anterior, care, la rândul său, reamintește sarcina electronică a carbonului adiacent și, prin urmare, a oxigenului, care va tinde să se disocieze în mod mai semnificativ protonul (dacă este plasat într-un mediu apos), determinând o valoare de K a de 10 -1 , care este mult mai mare decât acidul acetic (care are un K a egal cu 1,8 × 10 −5 ).
Utilizări
Acidul tricloracetic este capabil să precipite proteinele dizolvate, ADN-ul și ARN-ul în soluțiile sale apoase. Această proprietate este aplicată în mai multe sectoare.
Chimie analitică
Este utilizat pe scară largă în chimia biologică, deoarece soluțiile sale de 1% sau 5% sunt utilizate în mod obișnuit în laborator pentru a precipita proteinele în soluție. Orice soluție care conține proteine ( plasmă , sonicate de țesut etc.) dacă este adăugată cu un volum egal de 6% acid tricloracetic, aduce concentrația de acid la 3%, cu un pH mai mic de 2. La această valoare de aciditate, toate proteinele din soluție agregat și precipitat, permițând separarea lor de solvent.
Medicament
Acidul tricloracetic este, de asemenea, utilizat în medicina dermatologică pentru tratamentul local al negilor , deoarece acționează ca agent coroziv, precipitând proteine și deshidratând mediul înconjurător, favorizând eliminarea părții bolnave. Ar trebui să fie utilizat cu atenție (dacă este turnat pe țesuturile învecinate, poate modifica pielea sănătoasă, provocând ulcerații și liza țesuturilor superficiale și profunde, cum ar fi epiderma și dermul). [5]
Notă
- ^ Foaie de acid tricloracetic pe IFA-GESTIS
- ^ Wiley DJ și colab. (2002). Negi genitali externi: Diagnostic, tratament și prevenire. Boli infecțioase clinice, 35 (Supliment 2): S210 - S224
- ^ Proceedings of the American Philosophical Society
- ^ ( RO ) Fișă cu date de securitate
- ^ Carcinogen Potenta Baza de date (CPDB) Filed douăzeci și unu iulie 2011 în Internet Archive .
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre acidul tricloracetic
Wikimedia Commons conține imagini sau alte fișiere despre acidul tricloracetic
linkuri externe
- ( EN ) Acid tricloracetic , pe Encyclopedia Britannica , Encyclopædia Britannica, Inc.
| Controlul autorității | Thesaurus BNCF 52138 · GND (DE) 4292131-4 |
|---|